
| A. | 氧化产物与还原产物分子个数之比为15:1 | |
| B. | 氧化剂和还原剂是同一物质 | |
| C. | 反应过程中转移1mol电子,则产生2.24L气体(标准状况) | |
| D. | NaN3中氮元素的化合价为-3 |
分析 该反应中叠氮化钠中N元素化合价由-$\frac{1}{3}$价变为0价、硝酸钾中N元素化合价由+5价变为0价,所以硝酸钾是氧化剂、叠氮化钠是还原剂,再结合方程式分析解答.
解答 解:A.氮化钠中N元素化合价由-$\frac{1}{3}$价变为0价、硝酸钾中N元素化合价由+5价变为0价,所以硝酸钾是氧化剂,生成1N2为还原产物、叠氮化钠是还原剂,生成15N2为氧化产物,所以氧化产物与还原产物分子个数之比为15:1,故A正确;
B.硝酸钾是氧化剂、叠氮化钠是还原剂,故B错误;
C.反应过程中若转移1mol电子,则参加反应的叠氮酸钠的物质的量为1mol,生成氮气的物质的量=$\frac{1}{10}$=1.6mol,则产生35.84L气体(标准状况),故C错误;
D.叠氮化钠中N元素化合价为-$\frac{1}{3}$价,故D错误;
故选A.
点评 本题考查了氧化还原反应,明确方程式中元素化合价变化是解本题关键,注意叠氮化钠中氮元素化合价,为易错点.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中,一种元素被氧化,一定是另一种元素被还原 | |
| B. | 某元素由化合态变成游离态,此元素可能被氧化,也可能被还原 | |
| C. | 金属单质在反应中只能作还原剂,非金属单质只能作氧化剂 | |
| D. | 金属原子失电子越多,其还原性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水 | |
| B. | 将湿润的红色石蕊试纸放入集有氨气的集气瓶中,试纸由红色变为蓝色,说明氨水呈碱性 | |
| C. | 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定 | |
| D. | 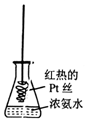 将红热的Pt丝伸入如图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的直接氧化产物为NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.0g | B. | 4.8g | C. | 3.2g | D. | 5.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ①③⑥ | C. | ②④ | D. | ②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中一定含有Cl- | |
| B. | 某溶液先加足量盐酸无现象,再滴加BaCl2溶液有白色沉淀,则原溶液中一定含有SO42- | |
| C. | 某无色溶液滴入酚酞显红色,该溶液中一定含有大量的H+ | |
| D. | 某溶液中滴加稀硫酸生成无色气体,说明原溶液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5<pH<7.1 | B. | 7.1<pH<9 | C. | 3<pH<7.1 | D. | 7.1<pH<11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度下,Ksp(AgCl)=1.8×10-10,Ksp (Ag2CrO4)=1.9×10-12,故Ag2CrO4更难溶 | |
| B. | 在CaCO3饱和溶液中,加入CaCl2固体,沉淀溶解平衡逆向移动,溶液中Ca2+浓度减小 | |
| C. | 溶度积常数Ksp与温度有关,温度越高,溶度积越大 | |
| D. | 在AgCl饱和溶液中,加入AgCl固体,平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
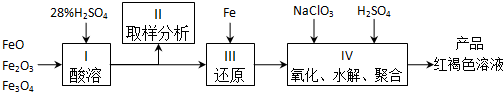
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com