
将W1g光亮的铜丝在空气中加热一段时间后,迅速插入下列物质中,取出干燥,如此反复几次,最后取出铜丝,用蒸馏水洗涤、干燥,称其质量为W2g,实验时由于所插入的物质不同,铜丝的前后质量变化可能不同,下列所插物质与铜丝的质量关系不正确的是( )
A.石灰水 W1<W2 B.CO W1=W2
C.NaHSO4溶液 W1>W2 D.乙醇 W1<W2
科目:高中化学 来源: 题型:
镁、铝、铁三种金属单质中的两种组成的混合物共 ,与足量的稀盐酸反应,产生标准状况下的氢气
,与足量的稀盐酸反应,产生标准状况下的氢气 ,由此可判断混合物中必定含有( )
,由此可判断混合物中必定含有( )
A、
B、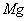
C、
D、无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl 和AlCl
和AlCl 组成的离子液体作电解液时,可在钢制品上电镀铝。
组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为__________________________________________。若改用AlCl3水溶液作电解液,则阴极产物为________。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有________。
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,______________(填“能”或“ 不能”)说明固体混合物中无Fe2O3,理由是________(用离子方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式的是 ( )
A.Fe3O4溶于足量稀HNO3中:Fe3O4+8H+===Fe2++2Fe3++4H2O
B.NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO +Ba2++OH-===BaCO3↓+H2O
+Ba2++OH-===BaCO3↓+H2O
C.将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O===HClO+ HSO
D.将0.2 mol·L-1 NH4Al(SO4)2溶液与0.3 mol·L-1 Ba(OH)2溶液等体积混合:2Al3++3SO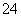 +3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
铜是生物必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式:________________________________________。
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出溶出铜的离子方程式:__________________________________________。
(3)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2。该反应中的氧化剂是____________;当生成19.2 g Cu时,反应中转移的电子的物质的量为________________________________________________________________________mol。
6Cu+SO2。该反应中的氧化剂是____________;当生成19.2 g Cu时,反应中转移的电子的物质的量为________________________________________________________________________mol。
(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜锈的主要成分为Cu2(OH)2CO3(碱式碳酸铜)。试写出上述过程中负极的电极反应式:______________________________________________________________。
(5)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取a g试样配成100 mL溶液,每次取25.00 mL该溶液,滴加KI溶液后有白色碘化物沉淀生成,写出该反应的离子方程式:____________________________。继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫代硫酸钠标准溶液滴定,发生反应的化学方程式为I2+2Na2S2O3===2NaI+Na2S4O6,平均消耗c mol/L Na2S2O3溶液的体积为V mL。则试样中CuSO4·5H2O的质量分数为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇在与浓硫酸混合共热的反应过程中,受反应条件的影响,可发生两类不同的反应类型:

1,4二氧六环是一种常见的溶剂。它可以通过下列合成路线制得:

其中的A可能是( )
A.乙烯 B.乙醇
C.乙二醇 D.乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中能大量共存的是
A.加入苯酚显紫色的溶液:K+、NH4+、Cl-、I-
B.加入酚酞呈红色的溶液:SO42-、K+、Cl-、HSO3-
C.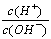 =1×10-12的溶液: K+、AlO2-、CO32-、Na+
=1×10-12的溶液: K+、AlO2-、CO32-、Na+
D.pH=2的溶液:NO3-、Fe2+、Na+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象、操作或反应原理的解释正确的是
| 现象、操作或反应 | 解释 |
| A.铝箔在酒精灯火焰上加热熔化不滴落 | 铝的熔点比氧化铝的熔点高 |
| B.向滴有稀硫酸的热淀粉液中滴加碘水,溶液呈蓝色 | 淀粉在此条件下未水解 |
| C.SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
| D.新制氯水中滴加石蕊试液,溶液先变红,后褪色 | 氯气与水反应生成HCl、HClO,HCl显强酸性,使石蕊变红,HClO具有强氧化性,使其褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关溶液组成的描述合理的是( )
A.无色溶液中可能大量存在Al3+、NH 、Cl-、S2-
、Cl-、S2-
B.酸性溶液中可能大量存在Na+、ClO-、SO 、I-
、I-
C.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com