
【题目】设NA为阿伏加德罗常数的值。下列叙述不正确的是
A.28gN2所含分子数为NA
B.0.2 mol/L Na2SO4中所含Na+ 数为0.4NA
C.标准状况下11.2L H2中所含原子数为NA
D.0.5mol CH4和1mol H2O中所含氢原子数均为2NA
科目:高中化学 来源: 题型:
【题目】1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:X(g) + aY(g)![]() bZ(g),反应达到平衡后,测得X的转化率为50% 。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
bZ(g),反应达到平衡后,测得X的转化率为50% 。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
A. a=l,b=2 B. a=2,b=1 C. a=2,b=2 D. a=3,b=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol甲烷与一定量的氯气混合于一量筒中,倒立于盛有饱和食盐水的水槽(如图所示),对于此反应,有关叙述不正确的是( )

A.该反应的有机生成物有四种,都为液体B.该反应的条件是光照,但是不能放在日光直射的地方
C.该反应属于取代反应D.该反应现象有量筒内气体颜色变浅,器壁上有油状液滴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1000mol/LNaOH溶液分别滴定20.00mL0.1000mol/LHCl和20mL0.1000mol/LCH3COOH,得到如图所示两条滴定曲线,下列说法不正确的是( )
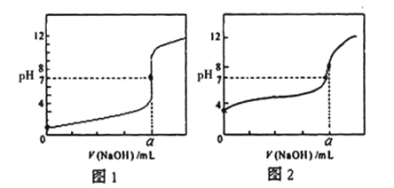
A.图1表示NaOH滴定盐酸的曲线
B.a=20mL
C.图2中,pH=7,c(CH3COO-)=c(Na+)
D.图1中,由水电离的c(H+)一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红矾钠(重铬酸钠:![]() )是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
)是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
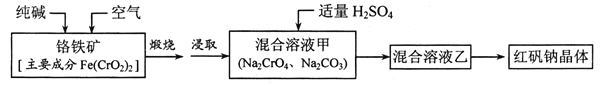
请回答下列问题:
(1)![]() 的基态电子排布式为____________。
的基态电子排布式为____________。
(2)锻烧铬铁矿发生反应:____________![]() 配平上述化学反应方程式。
配平上述化学反应方程式。
(3)溶液甲中加入H2SO4时,可以观察到溶液由黄色变为橙色,并放出无色气体,有 关反应的离子方程式为____________。
(4)制备红矾钠的废水必须进行处理。首先酸化废水,将含+6价铬的酸性废液放入电解槽内,用铁作阳极进行电解,阴极析出H2,阳极产物被![]() 氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
①阳极的电极反应式为(不考虑后续反应):____________。
②溶液中金属离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因:______。
③已知某含![]() 的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在医药卫生、高纯度金属提炼、光学仪器等领域起着至关重要的作用。从含碘化钾废液(可能还含有I2、IO3-)中回收I2,实验过程如下:
(1)确定碘的存在形式
①I2的确定:取含碘废液放入试管,加入CCl4,振荡静置,现象为_____,确定含有I2。
②IO3-的确定:取①中上层溶液,加入少量新配制的0.1mo/LFeSO4溶液,它的作用是____。振荡使之充分反应,再加入少量CCl4,CCl4层无紫色出现,说明该含碘废液中无IO3-。
(2)碘的回收
在含碘废液中加入适量的K2Cr2O7溶液和稀H2SO4,充分反应后经减压过滤得到粗碘,由粗碘提纯精制碘的装置如图:
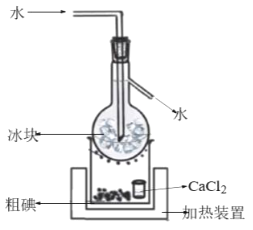
①补全得到粗碘的离子方程式:______。
□Cr2O72-+□I-+□ =□ +□Cr3++□ 。
②CaCl2的作用是__。
(3)碘的纯度分析(已知:2S2O32-+I2=2I-+S4O62-)
精确量取0.1136g精制后的碘置于250mL碘量瓶中,加入0.5gKI和30mL水,振荡至完全溶解(KI仅用于溶解)。以0.0513mol·L-1的Na2S2O3溶液快速滴定至淡黄色,加入1mL左右淀粉溶液,缓慢滴定至____,消耗Na2S2O3溶液17.26mL。碘的纯度的计算表达式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴藏着丰富的资源,海水综合利用的流程图如下:

(一)某化学研究小组用如图装置模拟步骤I电解食盐水(用铁和石墨做电极)。

(1)a电极材料是_____(填铁、石墨),其电极反应式为_________。
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为______(忽略反应前后溶液体积的变化)。
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+。
下表是生成氢氧化物沉淀的pH:
物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+,可选用的物质是_____(填序号,下同),加入_____调节溶液的pH,充分反应后过滤,可得MgCl2溶液。
a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2·H2O获得MgCl2的操作是:_________。
(三)制取工业溴:
(5)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是_______。
(6)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )

A. 汉黄芩素的分子式为C16H13O5
B. 该物质遇FeCl3溶液不显色
C. 1 mol该物质与溴水反应,最多消耗2 mol Br2
D. 与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室验证钠能与二氧化碳发生反应,并确定其产物的装置如图所示,(已知:PdC12溶液遇CO能产生黑色的Pd),下列说法错误的是( )

A. 装置①的仪器还可以制取H2气体
B. 装置⑤中石灰水变浑浊后,再点燃酒精灯
C. 装置②③中分别盛装饱和Na2CO3溶液、浓H2SO4
D. 装置⑥中有黑色沉淀,发生的反应是PdC12+CO+H2O=Pd↓+CO2+2HC1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com