
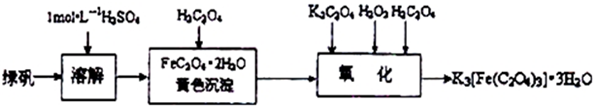
分析 (1)亚铁离子易被空气中的氧气氧化为铁离子,需要加入过量的铁粉避免亚铁离子被氧化;
(2)根据溶液来得到晶体来分析实验操作;
(3)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
(4)锌粉能与Fe3+反应,加入锌粉的目的是将Fe3+恰好还原成Fe2+;
(5)依据化学方程式或离子方程式计算,注意配制溶液的体积变化;加入的KMnO4的溶液的量不足,导致草酸根有剩余,再滴定亚铁离子时,进行与高锰酸钾反应,使的滴定亚铁离子消耗的高锰酸钾的体积偏大;
(6)根据气体的密度为求出其摩尔质量,然后根据摩尔质量和质量守恒来判断成分;依据信息:固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3,结合电子得失守恒,可推测铁元素只能以亚铁和铁单质的形式存在;最后写出方程式.
解答 解:(1)亚铁离子易被空气中的氧气氧化为铁离子,需要加入过量的铁粉避免亚铁离子被氧化,2Fe3++Fe=3Fe2+;
故答案为:铁;
(2)将混合液来制备绿矾时应先将溶液加热浓缩、然后冷却结晶,将析出的固体过滤、洗涤、干燥,即可得到绿矾,
故答案为:bcae;
(3)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管;
故答案为:250ml容量瓶;溶解,洗涤;
(4)向反应后的溶液中加入一小匙锌粉,加热至溶液完全由黄色变为浅绿色,说明加入锌粉的目的是将Fe3+恰好还原成Fe2+;
故答案为:将Fe3+还原成Fe2+,为进一步测定铁元素的含量做准备;
(5)再重复(1)、(2)步骤两次,滴定消耗0.01moL/KMnO4溶液平均体积为19.98mL;
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
5mol 1mol
n(Fe2+) 0.010×0.01998mol
配制成250moL溶液,取所配溶液25.00moL进行的中和滴定实验,含亚铁离子物质的量n(Fe2+)=5×0.010×0.01998mol:所以250ml溶液中亚铁离子物质的量为:10×5×0.010×0.01998mol:铁的质量分数ω(Fe)=[10×5×0.010×0.01998mol×56 g/mol]÷5.000 g×100%=11.12%;
加入的KMnO4的溶液的量不足,导致草酸根有剩余,再滴定亚铁离子时,进行与高锰酸钾反应,使的滴定亚铁离子消耗的高锰酸钾的体积偏大,导致测定的亚铁离子的物质的量偏大,故铁元素的质量偏大,计算测定的铁元素的质量分数偏高,
故答案为:11.12%;偏高;
(6)气体密度为1.647g/L,其摩尔质量为1.647g/L×22.4L/mol=36.9g/mol,所以气体为CO和C02,两者的物质的量之比$\frac{44-36.9}{36.9-28}$=$\frac{4}{5}$,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3,结合电子得失守恒,可推测铁元素只能以亚铁和铁单质的形式存在,故方程式为:2K3[Fe(C2O4)3]═3K2CO3+Fe+FeO+4CO↑+5CO2↑;
故答案为:2K3[Fe(C2O4)3]═3K2CO3+Fe+FeO+4CO↑+5CO2↑.
点评 本题考查较为综合,涉及到溶液的配制、滴定操作的指示剂选择,氧化还原反应的离子方程式的书写,化学方程式的计算,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题.


科目:高中化学 来源: 题型:选择题
| A. | 12g石墨和C60的混合物中质子总数为6NA | |
| B. | 1L1mol/L的甲醇水溶液中含有氢原子总数为4NA | |
| C. | 反应KIO3+6HI=KI+3H2O+3I2中,生成1molI2转移电子的总数为2NA | |
| D. | 1.8g2H2O所含中子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CO32-) | B. | c(Mg2+) | C. | c(H+) | D. | Ksp(MgCO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
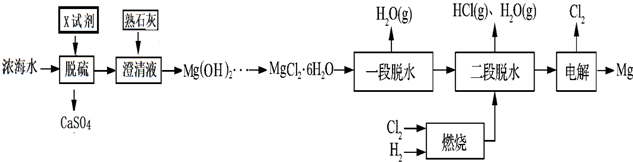
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
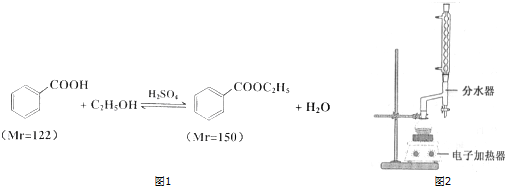
| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸* | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
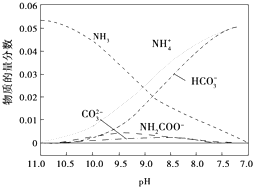
| A. | 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-) | |
| B. | 不同pH的溶液中存在关系:c(NH4+)+c(H+)═2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) | |
| C. | 在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成 | |
| D. | 随着CO2的通入,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=c(HA-)+2c(A2-)+c(OH-) | |
| B. | c(H2A)+c(HA-)+c(A2-)=0.1 mol•L-1 | |
| C. | 将上述溶液稀释至0.01mol/L,c(H+)•c(OH-) 不变 | |
| D. | c (A2-)+c (OH-)=c (H+)+c (H2A) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com