
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
|
阳离子 |
K+ Na+ Cu2+ Al3+ |
|
阴离子 |
SO42- HCO3- NO3- OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B ,D 。
(2)将含lmol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物,该化合物化学式为 。
(3)C常用作净水剂,用离子方程式表示其净水原理 。
(4)在A溶液中加入少量澄清石灰水,其离子方程式为 。
(5)向20mL 2mol/L C溶液中加入30mL E溶液,充分反应后得到0.78g沉淀,则E溶液的物质的量浓度可能是 moI/L。
(1)KNO3 CuSO4 (2)Na2CO3
(3)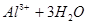


(4)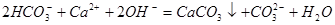 (5)1或5
(5)1或5
【解析】(1)D为蓝色溶液,则D中含有铜离子;根据实验②可知E是强碱,C中含有铝离子;根据实验③可知,E是氢氧化钠,C是硫酸铝钾;根据实验④可知A是碳酸氢钠,D是硫酸铜,则B是硝酸钾。
(2)碳酸氢钠和氢氧化钠反应生成的是碳酸钠。
(3)铝离子水解生成氢氧化铝胶体,具有吸附性,方程式为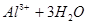

 。
。
(4)碳酸氢钠和少量的石灰水反应时,生成物应该是碳酸钙、碳酸钠和水,方程式为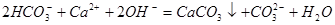 。
。
(5)溶液中含有0.04mol铝离子,而最终生成的氢氧化铝是0.01mol。由于氢氧化铝是两性氢氧化物,所以如果氢氧化钠不足,则氢氧化钠的物质的量是0.03mol,浓度就是0.03mol÷0.03L=1.0mol/L;如果氢氧化钠过量,生成的氢氧化铝部分溶解生成铝偏铝酸钠,则消耗氢氧化钠是0.04mol×3+0.03mol=0.15mol,所以浓度是0.15mol÷0.03L=5.0mol/L,有关的方程式为3OH-+Al3+=Al(OH)3↓、Al(OH)3|+OH-=AlO2-+2H2O。


科目:高中化学 来源: 题型:






查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
32 16 |
32 16 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:






查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com