
分析 根据价层电子对互斥理论确定中心原子杂化类型,再根据杂化类型确定分子或离子的空间构型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.
解答 解:PO43-中心原子为P,其中σ键电子对数为4,中心原子孤电子对数=$\frac{1}{2}$×(5+3-4×2)=0,PO43-中心原子价层电子对对数为4+0=4,P原子sP3杂化,立体构型为正四面体;
NO2中心原子N,其中σ键电子对数为2,中心原子存在大π键,所以孤电子对数为=$\frac{1}{2}$×(5-2×1-1)=1,中心原子价层电子对对数为=2+1=3,氮原子sP2杂化,分子空间构型为折线形,
NO3-中心原子N,其中σ键电子对数为3,中心原子孤电子对数=$\frac{1}{2}$×(5+1-3×2)=0,氮原子sP2杂化,无孤电子对数,分子空间构型为平面三角形,
故答案为:正四面体形;折线形;平面正三角形.
点评 本题考查了微粒空间构型,根据价层电子对互斥理论来分析解答,难点的孤电子对个数的计算方法,为常考查点,要熟练掌握,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷在氧气中燃烧 | B. | 氢氧化钠溶液与盐酸的反应 | ||
| C. | 氢氧化钡晶体与氯化铵晶体的反应 | D. | 铝与氧化铁在高温条件下的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水制得Cl2 | B. | 电解熔融MgCl2制得金属Mg | ||
| C. | 高温下CO还原赤铁矿可用于炼铁 | D. | 电解熔融AlCl3制得金属Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
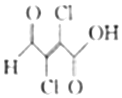 粘氯酸用于合成广谱高效新型杀螨剂哒螨酮、除草剂苯钠松,也用于医药磺胺吡啶和感光材料的合成,其结构简式如图所示.下列有关粘氯酸的说法不正确的是( )
粘氯酸用于合成广谱高效新型杀螨剂哒螨酮、除草剂苯钠松,也用于医药磺胺吡啶和感光材料的合成,其结构简式如图所示.下列有关粘氯酸的说法不正确的是( )| A. | 分子式为C4H2Cl2O3 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol粘氯酸与足量NaHCO3溶液反应,能产生标准状况下22.4LCO2 | |
| D. | 粘氯酸与足量H2反应生成M,则含一个甲基的M的同分异构体只有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 滴加少量硫酸铜溶液 | ||
| C. | 不用铁片,改用铁粉 | D. | 加少量浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量为36.5g | |
| B. | 含有6.02×1023个HCl分子 | |
| C. | 标准状况下的体积为44.8 L | |
| D. | 溶于1L水后,溶液中H+浓度为2mol.L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | a | b | c | 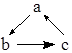 |
| A | Cu | CuO | Cu(OH)2 | |
| B | SiO2 | Na2SiO3 | H2SiO3 | |
| C | AlCl3 | NaAlO2 | Al(OH)3 | |
| D | CaO | Ca(OH)2 | CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com