
������A����(ÿ������ֻ��һ����ԭ��)�����Լ�һ�ֻ���±�أ�����A��ˮ��Ӧ����ȫˮ�������������ԭ�����з�Ӧ�����������ˮ����A���ˮ��Һϡ�ͺ� �ֳɼ��ݣ��ֱ����һϵ�е��Լ�����������:
�ֳɼ��ݣ��ֱ����һϵ�е��Լ�����������:
�ټ����������������������ɫ������
�ڼ����Ȼ�����Һ����������;
����Һ���ữ�������������Һ����ɫ��ȥ���ټ������ᱵ��Һ��������ɫ������
(1)�ɴ��ж���ɸû������Ԫ���У����ܴ��ڵ�±����____________��A��ˮ��Ӧ�����ɵ���Һ�к��е����ӿ�����_________________________��
(2)Ҫȷ���û�����ķ���ʽ����ȡ11.90g A����ˮϡ����250.0mL��ȡ25.00mL��Һ���������ĸ��������Һ�����ᱵ��Һ��ʹ������ȫ��������ϴ�ӡ��������أ�Ϊ2.33g����ȷ��A�Ļ�ѧʽ��д��������̡�
��1��F��Cl ��2�֣��� H+��SO32-��HSO3-��Cl-��F- ��2�֣�
��2����25.00 mL��Һ�в���n��BaSO4��=0.01mol, ��n(SO42��)=0.01mol
ԭA��n��S��=0.1mol, n (A) =n (S)=0.1mol,
M (A)=11.9 0g/ 0.1mol=119g/mol,
0g/ 0.1mol=119g/mol,
����SԪ����A�еĻ��ϼ�Ϊ+4�ۣ���A��ֻ��һ��Sԭ�ӣ���A��ֻ�ܺ���һ��
��ԭ�Ӻ�����±ԭ����A����Է�������Ϊ119��������±ԭ�ӵ����ԭ��������Ϊ��
119��32��16=71���ԣ�ֻ����������ԭ�ӣ�A�Ļ�ѧʽΪSOCl2 ��4�֣�


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���б�������ȷ����(����)
A��NH4Cl��Һ��ˮ��������ԣ���NH4Cl���������
B��������Һ��ˮ����Լ��ԣ�ˮ������ӷ���ʽΪCO ��2H2OH2CO3��2OH��
��2H2OH2CO3��2OH��
C��������̼��������ԣ����뷽��ʽΪH2CO32H����CO
D������FeCl3��Һʱ���Ƚ�FeCl3���ڽ�Ũ�������У�Ȼ���ټ�ˮϡ�͵�����Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ͼ��ʾװ�ý�������ʵ�飬�ܵó���Ӧʵ����۵���
| ѡ�� | �� | �� | �� | ʵ����� |
|
| A | Ũ���� | MnO2 | NaBr��Һ | ������Cl2>Br2 | |
| B | Ũ��ˮ | ��ʯ�� | AgNO3��Һ | AgOH�������� | |
| C | Ũ���� | Na2SO3 | FeCl3��Һ | SO2���л�ԭ�� | |
| D | ϡ���� | Na2CO3 | Na2SiO3 | �ǽ����ԣ�Cl>C>Si |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ѧϰ���о���ѧ��һ�ֳ��õĿ�ѧ���������з����������
�ٸ���������к���Hԭ�Ӹ��������ΪһԪ�ᡢ��Ԫ���
�ڼ���������һ���ǽ���������
�۸��ݶ��������ɽ���ɢϵ��Ϊ���塢��Һ����Һ
��SiO2���������������NaOH��Һ��Ӧ
�ݸ��ݷ�Ӧ����ЧӦ����ѧ��Ӧ��Ϊ���ȷ�Ӧ�����ȷ�Ӧ
A. �ڢ� B.�ڢܢ� C.�٢ڢ� D.�ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ��������þ��ͭ�Ͻ���뵽ϡ�����У�����ǡ����ȫ��Ӧ�����跴Ӧ�����л�ԭ����ȫ��NO����������Һ�м������ʵ���Ũ��Ϊ3mol/LNaOH��Һ��������ȫ��������ɳ�����������ԭ�Ͻ����������5.1 g���������й���������ȷ����
A.����Ͻ����������Ϊ9.6g
B.������ȫʱ����NaOH��Һ���Ϊ150mL
C.�μӷ�Ӧ����������ʵ���Ϊ0.4mol
D.�ܽ�Ͻ�ʱ����NO�������0.224L���Ա�״��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ij�л���  ������������ȷ���� ��������
������������ȷ���� ��������
A��1 mol���л��������3 mol Na������Ӧ��
B��1 mol���л��������3 mol NaOH������Ӧ
C��1 mol���л��������6 mol H2�����ӳɷ�Ӧ
D��1 mol���л���ֱ�������Na��NaHCO3��Ӧ����������������ͬ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ײ��϶�������(TiO2)���кܸߵĻ�ѧ���ԣ��������������Ĵ�����
��1����ҵ�϶������ѵ��Ʊ��ǣ�
I. �������Ľ��ʯ(��Ҫ�ɷ�TiO2,��Ҫ����SiO2)��̼�ۻ��װ���Ȼ�¯�У��ڸ�����ͨ��Cl2,�Ƶû���SiCl4���ʵ�TiCl4��
II. ������SiCl4���ʵ�TiCl4���룬�õ�������TiCl4��
III. ��TiCl4�м�ˮ�����ȣ�ˮ��õ�����TiO2•xH2O��
IV. TiO2��xH2O���·ֽ�õ�TiO2��
��TiCl4��SiCl4�ڳ����µ�״̬��_______��II������ȡ�IJ�������_______��
|

����ʵ��IV�У�Ӧ��TiO2.xH2O����_______ (���������)�м��ȡ�
��2���ݱ���������̬��·����������ʱ����һ������TiO2,TiO2��̫������������ĵ��ӱ�������ˮ�е�����ã�����H2O2,����̴������£�
���� a. O2��2O b. O+H2O��2OH(�ǻ�) c. OH+OH��H2O2
��b���ƻ����ǡ���������������������Թ��ۼ����Ǽ��Թ��ۼ�������
��H2O2�����·������е�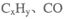 �ȣ�����Ҫ��������H2O2�ġ���������������ԡ���ԭ�ԡ�����
�ȣ�����Ҫ��������H2O2�ġ���������������ԡ���ԭ�ԡ�����
��3��������������Ҫ�Ļ�ѧ�Լ�������ˮ��Һ�ֳ�Ϊ˫��ˮ��������������ɱ����Ư�ȡ�ij��ѧ��ȤС��ȡһ�����Ĺ���������Һ��ȷ�ⶨ�˹�������ĺ�����
����д���пհף�
��ȡ10.00 mL�ܶ�ΪP g/mL�Ĺ���������Һϡ����250 mL��ȡϡ�ͺ�Ĺ���������Һ25.00mL����ƿ�У�����ϡ�����ữ��������ˮϡ�ͣ�������������
�ø�����ر���Һ�ζ������������䷴Ӧ�����ӷ���ʽ���£��뽫������ʵĻ�ѧ��������ƽ����ѧʽ��д�ڷ����
 MnO+ H2O2+ H+= Mn2++ H2O+
MnO+ H2O2+ H+= Mn2++ H2O+
�ڵζ�ʱ����������ر���Һע��______________�����ʽ����ʽ�����ζ����С��ζ������յ��������____________________________��
���ظ��ζ����Σ�ƽ������C mol/L KMnO4����Һ V mL,��ԭ����������Һ�й����������������Ϊ______________��
�����ζ�ǰ�ζ��ܼ����������ݣ��ζ���������ʧ����ⶨ���_________ ���ƫ�ߡ���ƫ�͡����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����뻯ѧ��Ӧ�����仯��ص�������ȷ����( )
A����H+(aq)��OH��(aq)��H2O(l�� ��H��-57.3 kJ��mol��1������0.1 mol HCl�������м���4��0 gNaOH���壬�ų���������5.73 kJ
B������H2��O2����ȫȼ������H2O(g)������H2O(l)���ų���������ͬ
C��ͬ��ͬѹ�£�H2(g)��Cl2(g)=2HCl(g)�ڹ��պ͵�ȼ�����µĦ�H��ͬ
D��������ȼ����Ϊ285.8 kJ��mol-1����ˮ�ֽ���Ȼ�ѧ����ʽΪ��2H2O(l)=2H2(g) + O2(g) ��H��+ 571.6 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����л�ѧ����ʽ�У��ܹ������ӷ���ʽH+ + OH��= H2O��ʾ����
A��������Һ������������Һ��Ӧ
B�������백ˮ��Ӧ
C������������Һ������������Һ��Ӧ
D������������������Һ��Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com