
分析 (1)配制100.00mL0.01500mol•L-1I2标准溶液,先在烧杯中溶解药品,用玻璃棒搅拌,转移到100mL容量瓶,定容,据此选择所必需的玻璃仪器;
(2)向饮料中加入稀硫酸并充分煮沸使糖类水解为葡萄糖;
(3)取 10.00mL 稀释液,加入 30.00mL 0.01500mol•L-1I2标准溶液,置于暗处15分钟,滴加2〜3滴淀粉溶液,再用0.01200mol•L-1Na2S2O3标准溶液滴定至终点,溶液颜色蓝色褪去证明反应恰好完成;
(4)C6H12O6+I2+3NaOH═C6H11O7Na+2NaI+2H2O,Na2S2O3 与I2能发生如下反应:I2+2Na2S2O3=2NaI+Na2S4O6,结合C6H12O6~I2~2Na2S2O3,先计算和葡萄糖反应的碘单质,结合化学方程式C6H12O6+I2+3NaOH═C6H11O7Na+2NaI+2H2O,计算葡萄糖含量.
解答 解:(1)配制100.00mL0.01500mol•L-1I2标准溶液,先在烧杯中溶解药品,用玻璃棒搅拌,转移到100mL容量瓶,定容,所必需的玻璃仪器有烧杯、玻璃棒、胶头滴管和100mL容量瓶,故答案为:l00mL容量瓶;
(2)向饮料中加入稀硫酸并充分煮沸的目的是:将饮料中糖类物质转化为葡萄糖,
故答案为:将饮料中糖类物质转化为葡萄糖;
(3)取 10.00mL 稀释液,加入 30.00mL 0.01500mol•L-1I2标准溶液,置于暗处15分钟,滴加2〜3滴淀粉溶液,再用0.01200mol•L-1Na2S2O3标准溶液滴定至终点,溶液颜色蓝色褪去证明反应恰好完成,滴定终点的现象为:溶液由蓝色恰好变为无色,且半分钟内不变色,
故答案为:溶液由蓝色恰好变为无色,且半分钟内不变色;
(4)取某无色饮料20.00mL加入稀硫酸充分煮沸,冷却,加入过量氢氧化钠溶液中和稀硫酸并稀释至 100.00mL,取 10.00mL 稀释液,加入 30.00mL 0.01500mol•L-1I2标准溶液,物质的量n(I2)=0.030.00L×0.01500mol•L-1=4.5×10-4mol,滴加2〜3滴淀粉溶液,再用0.01200mol•L-1Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3标准溶液25.00mL,
I2~2Na2S2O3,
1 2
1.5×10-4mol 0.01200mol•L-1×0.025.00L=3×10-4mol
与葡萄糖反应的碘单质物质的量n=4.5×10-4mol-1.5×10-4mol=3×10-4mol,
C6H12O6+I2+3NaOH═C6H11O7Na+2NaI+2H2O
得到葡萄糖物质的量=3×10-4mol,
该饮料中糖类物质的量=3×10-4mol×$\frac{100}{10}$=3×10-3mol,
计算该饮料中糖类物质的含量=$\frac{3×1{0}^{-3}mol×180g/mol}{20ml}$=0.02700g/ml=27.0mg•mL-1 ,
故答案为:27.00mg•mL-1.
点评 本题考查了物质组成的实验测定、物质性质、滴定实验过程分析和计算,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 300 | 230 | 169 | 58 |
| 30 | 158 | 108 | 50 | 15 |
| 50 | 31 | 26 | 15 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 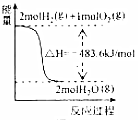 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ•mol-1 | |
| B. | 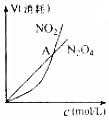 表示恒温恒容条件下发生的可逆反应2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 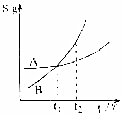 表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数A=B | |
| D. | 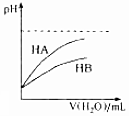 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| B. | 正四面体分子晶体内的键角一定是109°28′ | |
| C. | CuSO4溶液能使蛋白质溶液产生沉淀,该过程可用于提纯蛋白质 | |
| D. | NH3•H2O溶液加水稀释后,溶液中$\frac{c(N{H}_{3}{H}_{2}O)}{c(N{H}_{{4}^{+}})}$的值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH均为2的醋酸和盐酸加水稀释100倍,所得溶液的pH:醋酸>盐酸 | |
| B. | pH为11的氨水和pH为3的盐酸溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol/L的NaOH溶液和CH3COONa溶液等体积混合后的溶液:c(Na+)+c(CH3COO-)=c(OH-)+c(H+) | |
| D. | 浓度均为0.1mol/L的醋酸和CH3COONa溶液等体积混合,溶液中有下列关系:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
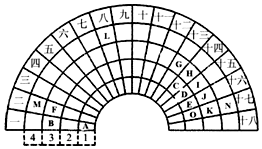 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题:
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题: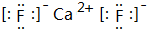 ,用电子式表示CJ2的形成过程:
,用电子式表示CJ2的形成过程: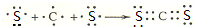 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铯的密度比金属钠小 | B. | 金属铯的熔点比金属钠高 | ||
| C. | Cs与H2O能剧烈反应,甚至发生爆炸 | D. | 碳酸铯难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com