
| A. | K+、Br-、CO32-、OH- | B. | H+、Br-、ClO-、SO42-、Na+ | ||
| C. | SO42-、Br-、H+、Fe3+ | D. | Br-、SO32-、OH-、K+ |
分析 某一无色溶液,若向其中加入足量饱和氯水,溶液呈橙色,则溶液中原来可能含有Br-;向橙色溶液中滴加BaCl2溶液,产生白色沉淀,沉淀应为硫酸钡沉淀,则含有SO42-;向原溶液中加入铝粉,有气体放出,则原溶液可能为酸或碱的溶液,以此来解答.
解答 解:某一无色溶液,若向其中加入足量饱和氯水,溶液呈橙色,则溶液中原来可能含有Br-;向橙色溶液中滴加BaCl2溶液,产生白色沉淀,沉淀应为硫酸钡沉淀,则含有SO42-;向原溶液中加入铝粉,有气体放出,则原溶液可能为酸或碱的溶液,
A.H+、CO32-能结合生成水和气体,不能共存,故A错误;
B.H+、Br-、ClO-发生氧化还原反应而不能大量共存,故B错误;
C.Fe3+有颜色,不符合题目无色要求,故C错误;
D.碱性条件下,可大量共存,故D正确.
故选D
点评 本题考查离子的共存,为高频考点,侧重学生的分析能力的考查,把握常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,注意常见物质的溶解性,题目难度不大.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸具有强烈的腐蚀性,应放于危险化学用品柜中妥善保管 | |
| B. | 取10mL该硫酸于烧杯中,再加18.4mL的水可配得9%的硫酸 | |
| C. | 配制200mL 4.6 mol/L的稀硫酸需取该硫酸50mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相等 | B. | 前者比后者大11倍 | ||
| C. | 后者是前者的1011倍 | D. | 后者是前者的108倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15 mL 1 mol/L 的FeCl3溶液 | |
| B. | 9.5 g MgCl2溶于水配成100 mL 溶液 | |
| C. | 143.5 g AgCl加入到100 mL 水中 | |
| D. | 在含有1.505×1021个Al3+的50 mL的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1 mol•L-1氨水中滴加0.lmol•L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=l0a-14mol•L-1 | |
| B. | 0.2mol•L-1 CH3COOH溶液与0.1mol•L-1 NaOH溶液等体积混合2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| C. | 常温时,将等浓度的碳酸钠和碳酸氢钠等体积混合,3c(Na+)=2[c(CO32-)+c(H2CO3)+c(HCO3-)] | |
| D. | 常温下,向0.1mol/L NH4HSO4溶液中滴加NaOH溶液至中性c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶于水呈酸性,可用来做杀菌剂 | |
| B. | 氨气具有还原性,可用于检查HCl泄漏 | |
| C. | MgO、Al2O3熔点高,可用于制作耐高温坩埚 | |
| D. | FeCl3溶液显酸性,可用于蚀刻印刷电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的c(H+):①=②=③=④ | |
| B. | 将②、③溶液混合后,pH=7,消耗溶液的体积:③=② | |
| C. | 等体积的①、②、④溶液分别与足量铝粉反应,②生成的H2的物质的量最大 | |
| D. | 向溶液中加入100mL水后,溶液的pH:③>④>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
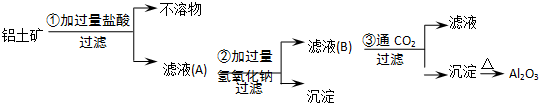
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com