
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A. | 该反应的化学方程式是:CO (g)+H2O (g)?CO2 (g)+H2(g) | |
| B. | 上述反应的正反应是放热反应 | |
| C. | 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol时,该反应为平衡状态 | |
| D. | 某温度下,如果平衡浓度符合下列关系式:$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,判断此时的温度是1000℃ |
分析 A.平衡常数是生成物浓度化学计量数次幂的乘积与反应物浓度化学计量数次幂的乘积的比值;
B.由表中数据可知,温度越高,平衡常数越小,说明升高温度,平衡向逆反应方向移动;
C.利用三段式计算出此时的各组分的物质的量,计算浓度商和该温度下的平衡常数比较判断;
D.根据关系式计算平衡常数,比较判断温度;
解答 解:A.化学反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•C({H}_{2})}{c(CO)•c({H}_{2}O)}$,而平衡常数是生成物浓度的化学计量数次幂的乘积与反应物浓度的化学计量数次幂的乘积的比值,故反应物是一氧化碳和水,生成物是二氧化碳和氢气,该反应的化学方程式是:CO(g)+H2O(g)?CO2(g)+H2(g),故A正确;
B.由表中数据可知,温度越高,平衡常数越小,说明升高温度,平衡向逆反应方向移动,所以该反应正反应是放热反应,故B正确;
C. CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):0 0 1 1
变化量(mol):0.4 0.4 0.4 0.4
5nim的量(mol):0.4 0.4 0.6 0.6
反应前后气体的体积不变,用物质的量代替浓度计算,故Qc=$\frac{0.6×0.6}{0.4×0.4}$=2.25>1,830°C时Qc不等于K,说明反应未达到平衡,故C错误;
D.某温度下,如果平衡浓度符合下列关系式:$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,则K=$\frac{c(C{O}_{2})•C({H}_{2})}{c(CO)•c({H}_{2}O)}$=0.6,对照平衡常数可知温度是1000℃,故D正确;
故选C.
点评 本题考查了化学平衡常数的意义、影响因素及应用,注意理解掌握化学平衡常数的有关应用,难度中等.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 六氟化氙(XeF6) | B. | 次氯酸(HClO) | C. | 三氟化硼(BF3) | D. | 氮气 (N2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| a | 原子核外电子分别占3个不同能级,且每个能级上排布的电子数相同 |
| b | 基态原子的p轨道电子数比s轨道电子数少1 |
| c | 在周期表所列元素中电负性最大 |
| d | 位于周期表中第4纵行 |
| e | 基态原子M层全充满,N层只有一个电子 |
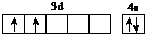 .
.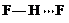 、
、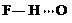 、
、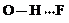 、
、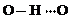 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
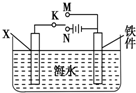 对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.
对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl、FeCl3、Na2SO4、I2 | B. | NaCl、FeBr3、Na2SO4 | ||
| C. | NaCl、Fe2O3、Na2SO4 | D. | NaBr、FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,B的结构简式
,B的结构简式 或
或 .
. ,反应类型:取代反应.
,反应类型:取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
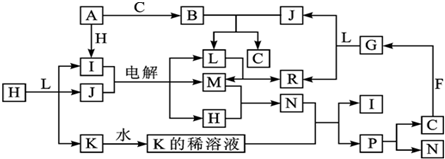
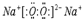 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com