
下列各基态原子或离子的电子排布式正确的是( )
|
| A. | O2﹣1s22s22p4 | B. | Ca[Ar]3d2 |
|
| C. | Fe[Ar]3d54s3 | D. | Si 1s22s22p63s23p2 |
考点:
原子核外电子排布.
专题:
原子组成与结构专题.
分析:
A.O2﹣离子核外电子数为10;
B.违背能量最低原理;
C.4s能级违背泡利原理;
D.符合能量最低原理.
解答:
解:A.O2﹣离子核外电子数为10,电子排布式是1s22s22p6,故A错误;
B.违背能量最低原理,Ca原子核外电子排布式为:[Ar]4s2,故B错误;
C.4s能级违背泡利原理,Fe原子核外电子排布式为:[Ar]3d64s2,故C错误;
D.Si原子核外电子数为14,核外电子排布式为1s22s22p63s23p2,故D正确,
故选D.
点评:
本题考查核外电子排布,比较基础,需要学生理解掌握核外电子排布规律.


科目:高中化学 来源: 题型:
(1)在一个恒温恒容的密闭容器中,可逆反应N2(g)+3H2(g)⇌2NH3(g)△H<0达到平衡的标志是 (填编号)
①反应速率v(N2):v(H2):v(NH3)=1:3:2
②各组分的物质的量浓度不再改变
③体系的压强不再发生变化
④混合气体的密度不变
⑤单位时间内生成n mol N2的同时,生成3n mol H2
⑥2V(N2正)=V(NH3逆)
⑦单位时间内3mol H﹣H键断裂的同时2mol N﹣H键也断裂
⑧混合气体的平均相对分子质量不再改变
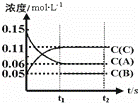
(2)向某体积固定的密闭容器中加入0.3mol A、0.1mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示.已知在反应过程中混合气体的平均分子量没有变化.请回答:
①密闭容器的体积是 L.
②若t1=15s时,则t0﹣t1阶段以C物质浓度变化表示的反应速率为v(C)= .
③写出反应的化学方程式: .
④B的起始物质的量是 .
(3)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式: .若1g水蒸气转化为液态水放热2.44kJ,则反应2H2(g)+O2(g)═2H2O(l)△H= kJ•mol﹣1.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.还原性:Na>K
B.热稳定性:NaHCO3>Na2CO3
C.等物质的量的NaHCO3和Na2CO3分别跟足量盐酸反应,消耗HCl的物质的量比为1∶2
D.等质量的NaHCO3和Na2CO3分别跟足量盐酸反应,产生CO2的物质的量比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学平衡常数的说法中,正确的是( )
|
| A. | 在任何条件下,化学平衡常数都是一个定值 |
|
| B. | 当改变反应物的浓度时,化学平衡常数会发生改变 |
|
| C. | 化学平衡常数K只与温度、反应物浓度、体系的压强都有关 |
|
| D. | 化学平衡常数K可以推断一个可逆反应进行的程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
0.3moL气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态B2O3和液态水,放出649.5KJ热量,请写出乙硼烷燃烧的热化学方程式 ;又已知:H2O(l)→H2O(g);△H=+44kJ/moL,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列微粒的个数比不是1:1的是( )
|
| A. | NaCl晶体中阴、阳离子 | B. | NH3分子中的质子和电子 |
|
| C. | Na2O2固体中阴、阳离子 | D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏加德罗常数,下列叙述正确的是( )
|
| A. | 标准状况下,含NA个氩原子的氩气的体积约为11.2 L |
|
| B. | 31g白磷分子中,含有的共价单键数目是NA个 |
|
| C. | 6 g金刚石晶体中含有的碳碳键数目为2×6.02×1023 |
|
| D. | 4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在温度压强不变的情况下,已知N2O4⇌2NO2,2mol N2O4在密闭容器内分解成NO2,到达平衡时生成了0.6mol NO2,则平衡时气体的总物质的量是( )
|
| A. | 0.6mol | B. | 1.8mol | C. | 2.2mol | D. | 2.3mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com