
| A、铝片与NaOH溶液反应:2OH-+Al═AlO2-+H2↑ |
| B、向AgCl悬浊液中滴加NaI溶液,白色沉淀变成黄色:AgCl+I-═AgI+Cl- |
| C、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
| D、将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O |


科目:高中化学 来源: 题型:
| A、向硅酸钠溶液中通入过量的CO2:SiO32-+2CO2+3H2O=H4SiO4↓+2HCO3- |
| B、氯化亚铁溶液与过氧化钠2:1反应:6Fe2++3Na2O2+6H2O=4Fe(OH)3↓+6Na++2Fe3+ |
| C、向氧化铁中加入氢碘酸发生反应:Fe2O3+6H++6I -=2Fe2++3I2+3H2O |
| D、过量铁粉与稀HNO3反应:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol/L氯化铜溶液中的Cu2+数小于NA |
| B、标准状况下,22.4L Cl2参加任何化学反应转移的电子数都是2NA |
| C、28 g聚乙烯含有的碳原子数为2NA |
| D、1mol CH5+所含电子数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制一定物质的量浓度的溶液时,定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水到刻度 |
| B、锥形瓶盛装待测液前需先用蒸馏水洗净,再用待测液润洗 |
| C、石蕊试纸在测定气体酸碱性时必须用蒸馏水润湿 |
| D、向稀氢氧化钠溶液中滴加饱和氯化铁溶液并不断搅拌,制取氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
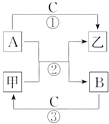 A、B、C是元素周期表中前18号元素中的3种单质,甲、乙是常见的化合物,它们之间存在如图所示关系.
A、B、C是元素周期表中前18号元素中的3种单质,甲、乙是常见的化合物,它们之间存在如图所示关系.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- |
| B、NaHCO3溶液中:c(HCO3-)+c(H2CO3)+c(CO32-)=c(Na+) |
| C、相同温度下,10 mL0.1 mol?L-1的醋酸与100 mL0.01mol?L-1的醋酸中的H+物质的量不相等 |
| D、中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com