
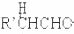 $\stackrel{Ļ”¼ī}{”ś}$
$\stackrel{Ļ”¼ī}{”ś}$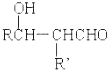
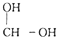 -OH$\stackrel{-H_{2}O}{”ś}$RCHO
-OH$\stackrel{-H_{2}O}{”ś}$RCHO £®
£® £®
£®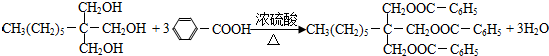 £®
£® ·ÖĪö ¼×ĶéŗĶĀČĘųŌŚ¹āÕÕĢõ¼žĻĀ·¢ÉśČ”“ś·“Ӧɜ³ÉA£ØCH2Cl2£©£¬AŗĶĒāŃõ»ÆÄʵÄĖ®ČÜŅŗ·¢ÉśČ”“ś·“Ӧɜ³ÉB£¬µ«Ķ¬Ņ»øöĢ¼Ō×ÓÉĻŗ¬ÓŠĮ½øöōĒ»ł²»ĪČ¶Ø»įŹ§Ė®Éś³ÉČ©£¬ŌņBµÄ½į¹¹¼ņŹ½ĪŖHCHO£¬CH3£ØCH2£©6CHOŗĶ¼×Č©·“Ӧɜ³ÉE£¬EÓėĒāĘų·¢Éś¼Ó³É·“Ӧɜ³ÉG£¬¶ųGµÄ·Ö×ÓŹ½ĪŖC10H22O3£¬øł¾ŻĢāøųŠÅĻ¢ÖŖ£¬EµÄ½į¹¹¼ņŹ½ĪŖ £¬ŌņGµÄ½į¹¹¼ņŹ½ĪŖ
£¬ŌņGµÄ½į¹¹¼ņŹ½ĪŖ £®¼×±½ŌŚ¹āÕÕĢõ¼žĻĀÓėĀČĘų·¢ÉśČ”“ś·“Ӧɜ³ÉC£¬CĖ®½āµĆµ½DĪŖ“¼£¬¶ų“¼DæÉŅŌĮ¬ŠųŃõ»Æ£¬æÉÖŖCŹĒ¼×±½ÖŠ¼×»łÖŠ1øöHŌ×Ó±»Č”“ś£¬¹ŹC½į¹¹¼ņŹ½ĪŖ
£®¼×±½ŌŚ¹āÕÕĢõ¼žĻĀÓėĀČĘų·¢ÉśČ”“ś·“Ӧɜ³ÉC£¬CĖ®½āµĆµ½DĪŖ“¼£¬¶ų“¼DæÉŅŌĮ¬ŠųŃõ»Æ£¬æÉÖŖCŹĒ¼×±½ÖŠ¼×»łÖŠ1øöHŌ×Ó±»Č”“ś£¬¹ŹC½į¹¹¼ņŹ½ĪŖ £¬Ė³ĶĘæÉÖŖDĪŖ
£¬Ė³ĶĘæÉÖŖDĪŖ £¬FĪŖ
£¬FĪŖ £¬IĪŖ
£¬IĪŖ £¬GŗĶI·“Ӧɜ³ÉH£¬HµÄ½į¹¹¼ņŹ½ĪŖ
£¬GŗĶI·“Ӧɜ³ÉH£¬HµÄ½į¹¹¼ņŹ½ĪŖ £¬¾Ż“Ė½ā“š£®
£¬¾Ż“Ė½ā“š£®
½ā“š ½ā£ŗ¼×ĶéŗĶĀČĘųŌŚ¹āÕÕĢõ¼žĻĀ·¢ÉśČ”“ś·“Ӧɜ³ÉA£ØCH2Cl2£©£¬AŗĶĒāŃõ»ÆÄʵÄĖ®ČÜŅŗ·¢ÉśČ”“ś·“Ӧɜ³ÉB£¬µ«Ķ¬Ņ»øöĢ¼Ō×ÓÉĻŗ¬ÓŠĮ½øöōĒ»ł²»ĪČ¶Ø»įŹ§Ė®Éś³ÉČ©£¬ŌņBµÄ½į¹¹¼ņŹ½ĪŖHCHO£¬CH3£ØCH2£©6CHOŗĶ¼×Č©·“Ӧɜ³ÉE£¬EÓėĒāĘų·¢Éś¼Ó³É·“Ӧɜ³ÉG£¬¶ųGµÄ·Ö×ÓŹ½ĪŖC10H22O3£¬øł¾ŻĢāøųŠÅĻ¢ÖŖ£¬EµÄ½į¹¹¼ņŹ½ĪŖ £¬ŌņGµÄ½į¹¹¼ņŹ½ĪŖ
£¬ŌņGµÄ½į¹¹¼ņŹ½ĪŖ £®¼×±½ŌŚ¹āÕÕĢõ¼žĻĀÓėĀČĘų·¢ÉśČ”“ś·“Ӧɜ³ÉC£¬CĖ®½āµĆµ½DĪŖ“¼£¬¶ų“¼DæÉŅŌĮ¬ŠųŃõ»Æ£¬æÉÖŖCŹĒ¼×±½ÖŠ¼×»łÖŠ1øöHŌ×Ó±»Č”“ś£¬¹ŹC½į¹¹¼ņŹ½ĪŖ
£®¼×±½ŌŚ¹āÕÕĢõ¼žĻĀÓėĀČĘų·¢ÉśČ”“ś·“Ӧɜ³ÉC£¬CĖ®½āµĆµ½DĪŖ“¼£¬¶ų“¼DæÉŅŌĮ¬ŠųŃõ»Æ£¬æÉÖŖCŹĒ¼×±½ÖŠ¼×»łÖŠ1øöHŌ×Ó±»Č”“ś£¬¹ŹC½į¹¹¼ņŹ½ĪŖ £¬Ė³ĶĘæÉÖŖDĪŖ
£¬Ė³ĶĘæÉÖŖDĪŖ £¬FĪŖ
£¬FĪŖ £¬IĪŖ
£¬IĪŖ £¬GŗĶI·“Ӧɜ³ÉH£¬HµÄ½į¹¹¼ņŹ½ĪŖ
£¬GŗĶI·“Ӧɜ³ÉH£¬HµÄ½į¹¹¼ņŹ½ĪŖ £®
£®
£Ø1£©BµÄ½į¹¹¼ņŹ½ĪŖHCHO£¬EµÄ½į¹¹¼ņŹ½ĪŖ £¬
£¬
¹Ź“š°øĪŖ£ŗHCHO£» £»
£»
£Ø2£©EµÄ½į¹¹¼ņŹ½ĪŖ £¬ŗ¬ÓŠµÄ¹ŁÄÜĶÅĪŖČ©»ł£¬¹Ź“š°øĪŖ£ŗČ©»ł£»
£¬ŗ¬ÓŠµÄ¹ŁÄÜĶÅĪŖČ©»ł£¬¹Ź“š°øĪŖ£ŗČ©»ł£»
£Ø3£©·“Ó¦¢Ł”«¢ŻÖŠ¢Ł¢Ś¢ŻŹōÓŚČ”“ś·“Ó¦£¬¹Ź“š°øĪŖ£ŗ¢Ł¢Ś¢Ż£»
£Ø4£©CH3£ØCH2£©6CHOÓŠ¶ąÖÖĶ¬·ÖŅģ¹¹Ģå·ūŗĻ£ŗA£®ÄÜ·¢ÉśŅų¾µ·“Ó¦£¬ĖµĆ÷ŗ¬ÓŠČ©»ł£¬B£®Ģž»łÉĻµÄŅ»ĀČČ”“śĪļÖ»ÓŠĮ½ÖÖ£¬Ģž»łÖŠŗ¬ÓŠ2ÖÖHŌ×Ó£¬æÉÄܵĽį¹¹¼ņŹ½ĪŖ£ŗ£ØCH3CH2£©3CCHO »ņ£ØCH3£©3CC£ØCH3£©2CHO£¬
¹Ź“š°øĪŖ£ŗ£ØCH3CH2£©3CCHO »ņ£ØCH3£©3CC£ØCH3£©2CHO£»
£Ø5£©FĪŖ £¬ŗ¬ÓŠČ©»ł£¬IĪŖ
£¬ŗ¬ÓŠČ©»ł£¬IĪŖ £¬ŗ¬ÓŠōČ»ł£¬¼ų±šFŗĶIµÄ·½·Ø£ŗ°ŃFŗĶ IÅä³ÉČÜŅŗ£¬·Ö±šµĪ¼Ó×ĻÉ«ŹÆČļŹŌŅŗ£¬Čē±äŗģµÄŹĒ±½¼×Ėį£Ø¼“I£©£¬²»±äÉ«µÄŹĒ±½¼×Č©£Ø¼“F£©£®»ņÕߏĒĄ¶É«ŹÆČļŹŌÖ½”¢Ņų¾µ·“Ó¦”¢ŠĀÖĘĒāŃõ»ÆĶŠü×ĒŅŗµČ£¬
£¬ŗ¬ÓŠōČ»ł£¬¼ų±šFŗĶIµÄ·½·Ø£ŗ°ŃFŗĶ IÅä³ÉČÜŅŗ£¬·Ö±šµĪ¼Ó×ĻÉ«ŹÆČļŹŌŅŗ£¬Čē±äŗģµÄŹĒ±½¼×Ėį£Ø¼“I£©£¬²»±äÉ«µÄŹĒ±½¼×Č©£Ø¼“F£©£®»ņÕߏĒĄ¶É«ŹÆČļŹŌÖ½”¢Ņų¾µ·“Ó¦”¢ŠĀÖĘĒāŃõ»ÆĶŠü×ĒŅŗµČ£¬
¹Ź“š°øĪŖ£ŗ°ŃFŗĶ IÅä³ÉČÜŅŗ£¬·Ö±šµĪ¼Ó×ĻÉ«ŹÆČļŹŌŅŗ£¬Čē±äŗģµÄŹĒ±½¼×Ėį£Ø¼“I£©£¬²»±äÉ«µÄŹĒ±½¼×Č©£Ø¼“F£©£»
£Ø6£©·“Ó¦¢ŚŹĒ ŌŚĒæ¼īČÜŅŗÖŠ·¢ÉśµÄĖ®½ā·“Ӧɜ³É±½¼×“¼£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ
ŌŚĒæ¼īČÜŅŗÖŠ·¢ÉśµÄĖ®½ā·“Ӧɜ³É±½¼×“¼£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ £¬·“Ó¦¢ŻµÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ
£¬·“Ó¦¢ŻµÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ £¬
£¬
¹Ź“š°øĪŖ£ŗ £»
£» £®
£®
µćĘĄ ±¾Ģāæ¼²éĮĖÓŠ»śĪļµÄĶʶĻ£¬ŹģĮ·ÕĘĪÕ¹ŁÄÜĶŵĊŌÖŹÓė×Ŗ»ÆŹĒ¹Ų¼ü£¬×¢ŅāŠÅĻ¢ÖŠČ©µÄ¼Ó³É·“Ó¦ĢŲµć£¬ĄūÓĆĖ³ĶĘ·ØÓėÄęĶĘ·ØĻą½įŗĻ½ųŠŠĶʶĻ£¬ÄѶČÖŠµČ£®


 ĘŚÄ©100·Ö“³¹Ųŗ£µķæ¼ĶõĻµĮŠ“š°ø
ĘŚÄ©100·Ö“³¹Ųŗ£µķæ¼ĶõĻµĮŠ“š°ø Š”ѧÄÜĮ¦²āŹŌ¾ķĻµĮŠ“š°ø
Š”ѧÄÜĮ¦²āŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
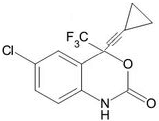
| A£® | øĆ»ÆŗĻĪļÖŠŗ¬ÓŠ1øöŹÖŠŌĢ¼Ō×Ó | |
| B£® | øĆÓŠ»ś»ÆŗĻĪļ·Ö×ÓŹ½ĪŖ£ŗC14H8ClF3NO2 | |
| C£® | øĆ»ÆŗĻĪļÄÜ·¢ÉśĖ®½ā”¢¼Ó³É”¢Ńõ»ÆŗĶĻūČ„·“Ó¦ | |
| D£® | 1moløĆ»ÆŗĻĪļÓė×ćĮæH2 ·“Ó¦£¬×ī¶ąĻūŗÄ5mol H2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  £Ø2-ŅŅ»ł±ūĶ飩 £Ø2-ŅŅ»ł±ūĶ飩 | B£® | CH3CH2CH2CH2OH£Ø1-¶”“¼£© | ||
| C£® |  £Ø¼ä¶ž¼×±½£© £Ø¼ä¶ž¼×±½£© | D£® | CH3C£ØCH3£©=CH2£Ø2-¼×»ł-2-±ūĻ©£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| »ÆŗĻĪļ | Fe£ØOH£©2 | Fe£ØOH£©3 | FePO4 | Fe3£ØPO4£©2 |
| Ksp½üĖĘÖµ | 10-17 | 10-38 | 10-22 | 10-36 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
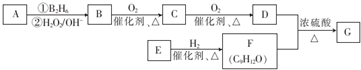
 £»øĆ·“Ó¦µÄ·“Ó¦ĄąŠĶĪŖõ„»Æ·“Ó¦»ņČ”“ś·“Ó¦
£»øĆ·“Ó¦µÄ·“Ó¦ĄąŠĶĪŖõ„»Æ·“Ó¦»ņČ”“ś·“Ó¦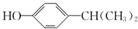
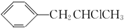 ĪŖŌĮĻŅ²æÉŗĻ³ÉF£¬Ēė²Īæ¼ĢāÄæÖŠµÄĻą¹ŲŠÅĻ¢Š“³öĻąÓ¦µÄŗĻ³ÉĀ·ĻßĶ¼£Ø·“Ó¦Ģõ¼žÖŠµÄŹŌ¼ĮŠ“ŌŚ¼żĶ·ÉĻ·½£¬ĘäĖūŠ“ŌŚ¼żĶ·ĻĀ·½£©£ŗ
ĪŖŌĮĻŅ²æÉŗĻ³ÉF£¬Ēė²Īæ¼ĢāÄæÖŠµÄĻą¹ŲŠÅĻ¢Š“³öĻąÓ¦µÄŗĻ³ÉĀ·ĻßĶ¼£Ø·“Ó¦Ģõ¼žÖŠµÄŹŌ¼ĮŠ“ŌŚ¼żĶ·ÉĻ·½£¬ĘäĖūŠ“ŌŚ¼żĶ·ĻĀ·½£©£ŗ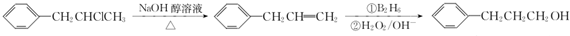 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
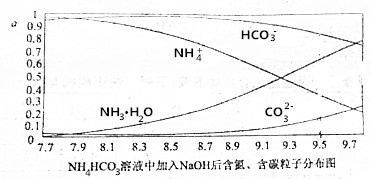
| A£® | æŖŹ¼½×¶Ī£¬HCO3-·“¶ųĀŌÓŠŌö¼Ó£¬æÉÄÜŹĒŅņĪŖNH4HCO3ČÜŅŗÖŠ“ęŌŚH2CO3·¢ÉśµÄÖ÷ŅŖ·“Ó¦ŹĒH2CO3+OH-ØTHCO3-+H2O | |
| B£® | µ±pH“óÓŚ8.7ŅŌŗó£¬Ģ¼ĖįĒāøłĄė×ÓŗĶļ§øłĄė×ÓĶ¬Ź±ÓėĒāŃõøłĄė×Ó·“Ó¦ | |
| C£® | pH=9.5Ź±£¬ČÜŅŗÖŠc£ØHCO3-£©£¾c£ØHN3•H2O£©£¾c£ØNH4+£©£¾c£ØCO32-£© | |
| D£® | µĪ¼ÓĒāŃõ»ÆÄĘČÜŅŗŹ±£¬Ź×ĻČ·¢ÉśµÄ·“Ó¦ĪŖ2NH4HCO3+2NaOHØT£ØNH4£©2CO3+Na2CO3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ė® | B£® | ĖÄĀČ»ÆĢ¼ | C£® | ŃĪĖį | D£® | ĮņĖįÄųČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ·“Ó¦¢ń£ŗCO2£Øg£©+3H2£Øg£©?CH3OH£Øg£©+H2O£Øg£© | ”÷H1=-49.01kJ•mol-1 |
| ·“Ó¦¢ņ£ŗ2CH3OH£Øg£©?CH3OCH3£Øg£©+H2O£Øg£© | ”÷H2=-24.52kJ•mol-1 |
| ·“Ó¦¢ó£ŗCH3OCH3£Øg£©?C2H4£Øg£©+H2O£Øg£© | ”÷H3=-5.46kJ•mol-1 |
| ·“Ó¦¢ō£ŗ2CO2£Øg£©+6H2£Øg£©?C2H4£Øg£©+4H2O£Øg£© | ”÷H4 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com