
【题目】现用质量分数98%、密度为1.84g/cm3浓H2SO4来配制450mL、0.2mol/L的稀H2SO4 .
(1)经计算,需浓H2SO4的体积为 .
(2)除烧杯、玻璃棒、量筒外,配制上述溶液还需要的玻璃仪器是 .
(3)在配制过程中,其他操作都准确,下列操作中,能引起浓度偏高的有(填代号).
①将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4;
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中;
③洗涤溶解用的烧杯与玻璃棒,并将洗涤液转移到容量瓶中;
④转移前,容量瓶中含有少量蒸馏水;
⑤定容时,俯视标线;
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线.
【答案】
(1)5.4mL
(2)500mL容量瓶、胶头滴管
(3)②⑤
【解析】解:(1)量分数98%、密度为1.84g/cm3浓H2SO4的c= ![]() =18.4mol/L,配制450mL、0.2mol/L的稀H2SO4,应用500mL容量瓶,则需浓H2SO4的体积为
=18.4mol/L,配制450mL、0.2mol/L的稀H2SO4,应用500mL容量瓶,则需浓H2SO4的体积为 ![]() =0.0054L=5.4mL,
=0.0054L=5.4mL,
故答案为:5.4mL;
(2)根据配制500mL 0.2mol/L的稀硫酸步骤可知,需要选用的仪器为:量筒、烧杯、玻璃棒、500ml容量瓶、胶头滴管,还缺少的仪器为:500mL容量瓶、胶头滴管,
故答案为:500mL容量瓶、胶头滴管;
(3)①将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸,稀释浓硫酸时,应该将浓硫酸缓缓加入水中,顺序不能颠倒,故①错误;
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中,热的溶液体积判断,冷却后溶液体积变小,配制的溶液浓度偏高;
③洗涤溶解用的烧杯与玻璃棒,并将洗涤液转移到容量瓶中,正确;
④转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量及溶液体积没有影响,不影响配制结果;
⑤定容时,俯视标线,导致加入的蒸馏水体积偏小,配制的溶液浓度偏高;
⑥定容时,加蒸馏水超过标线,又用胶头滴管吸出,导致溶质的物质的量偏小,配制的溶液浓度偏低;
根据以上分析可知,错误的操作有:①②⑤⑥;能引起实验结果偏高的有:②⑤,
故答案为:②⑤.
(1)根据浓溶液的稀释定律尽心计算需要浓硫酸的体积;
(2)根据实验室中配制一定物质的量浓度的溶液的步骤判断需要的仪器;
(3)根据![]() 进行分析溶液的体积和溶质的物质的量变化,然后做出判断即可.
进行分析溶液的体积和溶质的物质的量变化,然后做出判断即可.


科目:高中化学 来源: 题型:
【题目】以下关于化学实验中“先与后”的说法中正确的是
①蒸馏时.先点燃酒精灯,再通冷凝水
②蒸馏时先加热,再加沸石
③实验室制取某气体时,先检查装置气密性后装药品
④还原CuO实验时,先检验气体纯度后点燃酒精灯加热
⑤分液时,先倒出上层液体,再放出下层液体
⑥分液时,先打开分液漏斗上口的塞子,后打开分液漏斗的旋塞
A. ③④⑤ B. ①③④ C. ②③④ D. ③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难挥发性二硫化钽(TaS2)可采用如下装置提纯.将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中.反应如下:TaS2(s)+2I2(g)TaI4(g)+S2(g)下列说法正确的是( ) ![]()
A.在不同温度区域,TaI4的量保持不变
B.在提纯过程中,I2的量不断减少
C.在提纯过程中,I2的作用是将TaS2从高温区转移到低温区
D.该反应的平衡常数与TaI4和S2的浓度乘积成反比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法不正确的是( ) 
A.原子半径Z<M
B.Y的最高价氧化物对应水化物的酸性比X的弱
C.X的最简单气态氢化物的热稳定性比Z的小
D.Z位于元素周期表中第2周期第ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门.下列说法不正确的是( ) 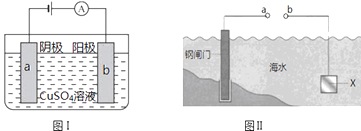
A.图Ⅰ中a为纯铜
B.图Ⅰ中SO42﹣向b极移动
C.图Ⅱ中如果a、b间连接电源,则a连接负极
D.图Ⅱ中如果a、b间用导线连接,则X可以是铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应4Fe(OH)2(s)+O2(g)+2H2O(l)=4Fe(OH)3(s)△H=﹣444.3kJ/mol,在常温常压下能自发进行,对反应的方向起决定作用的是( )
A.焓变
B.温度
C.压强
D.熵变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含分子数相同的是( )
A.10 g H2和10 g O2
B.5.6 L N2(标准状况)和22 g CO2
C.9 g H2O和0.5 mol Br2
D.224 mL H2和0.01 mol N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X,Y,Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
A.反应开始到10 s,用Z表示的反应速率为0.079mol(Ls)﹣1
B.反应开始到10 s,X的物质的量浓度减少了0.79molL﹣1
C.该反应不是可逆反应
D.反应的化学方程式为X(g)+Y(g)Z(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com