
化学与社会、生活、生产密切相关。对下列现象或事实的解释正确的是
| 选项 | 现象或事实 | 解释 |
| A | 用明矾净水 | 明矾具有杀菌消毒的作用 |
| B | “84”消毒液具有漂白性 | “84”消毒液中的NaClO与空气中的CO2反应生成HClO |
| C | 潮湿环境中的铁制品生锈 | 铁制品中的Fe与空气中的O2直接反应生成Fe2O3 |
| D | 局部地区出现酸雨 | 煤、石油的燃烧产生大量CO2 |
【知识点】化学与生活 D3 D2
【答案解析】B 解析:A、用明矾净水是利用了明矾电离产生的铝离子发生水解生成的氢氧化铝胶体具有表面比较大的性质,具有一定的吸附性对水的净化作用,而不是杀菌消毒的作用,错误;B、“84”消毒液具有漂白性是由于其中的溶质NaClO与空气中的CO2反应生成的HClO的强氧化性,正确;C、铁生锈是铁、碳与空气中的水蒸气形成了原电池发生的是电化学腐蚀,错误;D、酸雨是煤、石油的燃烧产生的SO2而导致,错误。
【思路点拨】本题考查了明矾净水的原理,“84”消毒液消毒的原理,铁生锈的电化学腐蚀等知识点,这些知识与生活有很大的联系,只要把这些物质的性质掌握就会解决问题,基础性较强。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
已知: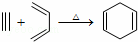 ,如果要合成
,如果要合成 所用的原始原料可以是( )
所用的原始原料可以是( )
|
| A. | 2﹣甲基﹣1,3﹣丁二烯和2﹣丁炔 |
|
| B. | 1,3﹣戊二烯和2﹣丁炔 |
|
| C. | 2,3﹣二甲基﹣1,3﹣戊二烯和乙炔 |
|
| D. | 2,3﹣二甲基﹣1,3﹣丁二烯和丙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
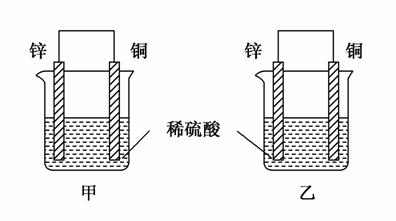
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的酸性均减弱
D.产生气泡的速率甲比乙慢
查看答案和解析>>
科目:高中化学 来源: 题型:
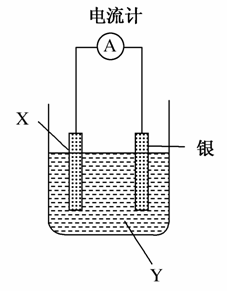
依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是________。
(2)银电极为电池的________极,发生的电极反应为________;X电极上发生的电极反应为________。
(3)外电路中的电子是从________电极流向________电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中,属干这种情况的是
①过量锌与18 mol/L的硫酸反应;
②过量氢气与少量氮气在催化剂存在下充分反应;
③浓盐酸与过量的MnO2反应;
④过量铜与浓硫酸反应;
⑤过量稀硝酸与银反应;
⑥过量稀硫酸与大块状石灰石反应。
A.②③④⑥ B.②③⑤ C.①④⑤ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活、社会密切相关。下列说法正确的是
A.光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材料主要是SiO2
B.氨很容易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂
C.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性
D.SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作、现象和解释或结论都正确的是
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业制硝酸的主要反应是4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-1025 kJ·mol-1
(1)该反应的平衡常数表达式为K=________;升高温度,K值________(填“增大”或“减小”或“不变”)。
(2)若反应物起始的物质的量相同,下列关系图错误的是______
(填序号)。

(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 浓度 时间 | c(NH3) (mol·L-1) | c(O2) (mol·L-1) | c(NO) (mol·L-1) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.8 | 1.6 | 0.5 |
①起始时物料比c(O2)c(NH3)>1.25,其原因是________;
②反应在第2min到第4min时,O2的平均反应速率为__________mol·L-1·min-1;
③反应在第2min时改变了反应条件,改变的条件可能是__________(填序号);
a.使用催化剂 b.升高温度
c.充入He气体 d.增加O2的浓度
④反应在第8min时改变的反应条件可能是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com