
| 1 |
| 2 |


科目:高中化学 来源: 题型:
 向下列各组物质的混合溶液中滴加NaOH溶液,其现象与图象描述一致的是( )
向下列各组物质的混合溶液中滴加NaOH溶液,其现象与图象描述一致的是( )| A、HCl和Ba(NO3)2 |
| B、CuSO4和H2SO4 |
| C、CuSO4和Na2SO4 |
| D、Na2SO4和Ba(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验现象 | 实验结论 | |
| 实验一 | 取5mL5%的过氧化氢溶液于试管中,伸入带火星的木条 | 有少量气泡产生,木条不复燃 | 过氧化氢分解产生氧气,但是反应较慢. |
| 实验二 | 二氧化锰能加快过氧化氢的分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol CH4所含原子总数是5NA |
| B、32g硫与足量铜完全反应转移的电子数为2NA |
| C、2L 1mol/L的盐酸溶液中,所含氯化氢分子个数是2NA |
| D、2mol SO2和1mol O2混合后,在V2O5存在的条件下密闭容器中加热反应后,容器内分子总数是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
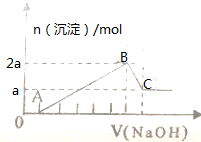 100mL某无色溶液由H+、Na+、Mg2+、Al3+、Fe3+、CO32-、Cl-等离子中的几种混合组成(不考虑水电离出的离子),向溶液中逐滴加0.5mol/L氢氧化钠溶液直到过量,产生沉淀的情况如图所示.
100mL某无色溶液由H+、Na+、Mg2+、Al3+、Fe3+、CO32-、Cl-等离子中的几种混合组成(不考虑水电离出的离子),向溶液中逐滴加0.5mol/L氢氧化钠溶液直到过量,产生沉淀的情况如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、试管内壁附着的硫黄可以用热的KOH溶液洗涤,也可以用CS2洗涤 |
| B、盛Na2SO3、Na2S、KI溶液的试剂瓶不能用玻璃塞,贮存时应盖好瓶塞,防止被空气氧化 |
| C、金属镁着火可用干粉灭火器灭火,也可用泡沫灭火器灭火 |
| D、从硫酸铜溶液中获取硫酸铜晶体,可以用蒸发结晶,也可以用冷却结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、②③④ |
| C、②③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅胶、生石灰、浓硫酸 |
| B、碱石灰、亚硫酸钠、浓盐酸 |
| C、碳酸钠晶体、无水硫酸铜、食盐 |
| D、苛性钠、无水乙醇、浓氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①③⑤ |
| C、③④ | D、③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com