
1808年,英国化学家用钾还原氧化镁,最早制得少量的镁。镁是航空工业的重要材料,镁作为一种强氧化剂,还用于钛、铍和铀的生产中。
(1)镁在元素周期表中的位置为_________________________.
(2)写出用镁与金红石(主要成分为Ti O2)在加热条件下制取钛的化学方程式:_____________________________________.
(3)镁在加热的条件下还能与NaOH固体反应,生成MgO和单质X、单质Y。已知X与水反应可生成单质Y,则镁与NaOH反应的化学方程式为____________________.
(4)镁—过氧化氢电池的工作原理如图所示,该电池放电时总反应的化学方程式为______________________________________.
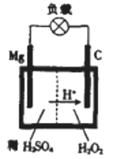
【知识点】反应方程式的书写、原电池原理 B3 F3
【答案解析】(I)第三周期IIA族
(2)2Mg+TiO2  Ti+2MgO
Ti+2MgO
(3)2Mg+2NaOH 2MgO+2Na+H2↑
2MgO+2Na+H2↑
(4)Mg+ H2O2+ H2SO4= MgSO4+2H2O(每空2分)
解析:(1)镁原子核外有12个电子,三个电子层,最外层有2个电子,所以镁在元素周期表中的第三周期IIA族。
(2)根据提示:镁与金红石(主要成分为Ti O2)在加热条件下制取钛可知发生的是置换反应。2Mg+TiO2  Ti+2MgO
Ti+2MgO
(3)镁在加热的条件下还能与NaOH固体反应,生成MgO和单质X、单质Y。利用质量守恒定律以及X与水反应可生成单质Y,得到X是钠、Y是氢气。
(4)观察电池的工作原理图,活泼金属镁做负极被氧化得到Mg2+,H2O2被还原为H2O,电池放电时总反应的化学方程式为Mg+ H2O2+ H2SO4= MgSO4+2H2O。
【思路点拨】本题考查了反应方程式的书写、原电池原理,难度不大,分析原电池时要与氧化还原相联系。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
给下列苯的同系物命名
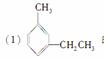 的系统名称为
的系统名称为
________________________________________________________________________。
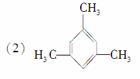 的系统名称为
的系统名称为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
据最新报道,科学家发现了如下反应:O2+PtF6 = O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列叙述正确的是
A.在此反应中,每生成1molO2(PtF6),则转移1mol电子
B.在此反应中,O2是氧化剂,PtF6是还原剂
C.O2(PtF6)中氧元素的化合价是+1价
D.O2(PtF6)中仅存在离子键不存在共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
科技工作者提出用铝粉处理含亚硝酸盐废水的思路:调节亚硝酸盐废水酸碱性,使其pH>12,然后加入适量的铝粉、搅拌,从而实现预期目的。下列判断错误的是
A.废水处理时铝单质转化为Al3+ B.废水处理中,亚硝酸盐被还原
C.处理过程中,OH一参与了反应 D.铝粉颗粒大小影响废水处理的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni且均显+2价,下同)由铁酸盐(MFe2O4)经高温还原而得。常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
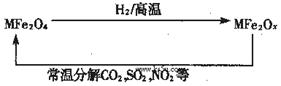
(1)已知铁酸盐(MFe2O4)被H2高温还原时,发生反应的MFe2O4与H2的物质的量之比为 2︰1,则还原产物 MFe2Ox 中x=______,MFe2Ox 中+2价铁与+3价铁的量之比为_____。
(2)在酸性溶液中,Fe2O42-易转化为Fe2+:Fe2O42-+2e-+8H+→2Fe2++4H2O有 KMnO4、Na2CO3、Cu2O、Fe2(SO4)3 四种物质中的一种能使上述还原过程发生,写出该氧化还原反应的离子方程式并配平_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
.向含有一定量盐酸和少量MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生沉淀的质量m与加入Ba(OH)2的物质的量n之间的关系如图所示,下列说法正确的是

A. 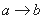 时的沉淀成分为BaSO4与Mg(OH)2
时的沉淀成分为BaSO4与Mg(OH)2
B. 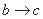 时发生的离子反应为H++OH-=H2O
时发生的离子反应为H++OH-=H2O
C. c点时的溶液中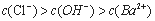
D. 原混合溶液中:n(HCl)=2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组取一定质量的Fe SO4固体,利用图中装置进行实验。
SO4固体,利用图中装置进行实验。
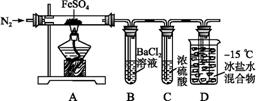
| 实验过程 | 实验现象 | |
| ① | 通入一段时间N2,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| ② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| ③ | 充分反应, | 固体溶解,溶液呈黄色 |
| ④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
已知:SO2熔点为-72 ℃,沸点为-10 ℃;SO3熔点为16.8 ℃,沸点为44.8 ℃。
(1)实验③反应的离子方程式是 。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有 气体,依据是 。
(3)实验④反应的离子方程式是 。
(4)某同学依据B中的现象,认为FeSO4 分解一定有SO3生成。你认为是否正确,其原因是 (用必要的文字和化学方程式解释)。
分解一定有SO3生成。你认为是否正确,其原因是 (用必要的文字和化学方程式解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
碲(Te)为ⅥA族元素,是当今高新技术新材料的主要成分之一。工业上可从电解精炼铜的阳极泥中提取碲。
(1)粗铜中含有Cu和少量Zn、Ag、Au、TeO2及其他化合物,电解精炼后,阳极泥中主要含有TeO2、少量金属单质及其他化合物。电解精炼粗铜时,阳极电极反应式为____________。
(2)TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。从上述阳极泥中提取碲的一种工艺流程如下:
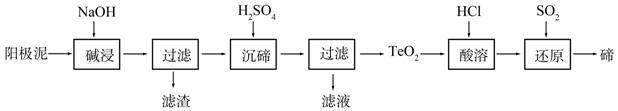
①“碱浸”时TeO2发生反应的化学方程式为_______________________________________。
②“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4过量,溶液酸度过大,将导致碲的沉淀
不完全,原因是____________________________________;防止局部酸度过大的操作方法是_______________________________________________________________。
③“酸溶”后,将SO2通入TeCl4溶液中进行“还原”得到碲,该反应的化学方程式是
______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
三氯异氰尿酸(结构简式如图)是养蚕业和水产养殖业最重要的消毒剂,三氯异氰尿酸水解生成X和NH4HCO3。下列关于X的说法不正确的是
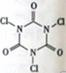
A.X的结构式为H—Cl—O B.X有强氧化性
C.X属于弱酸 D.X属于电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com