
【题目】合成氨是人类科学技术上的一项重大突破,反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
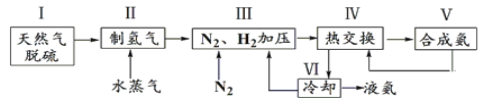
(1)①步骤Ⅱ中制氢气的原理如下:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g);K1
CO(g)+3H2(g);K1
b.CO(g)+H2O(g)![]() CO2(g)+H2(g);K2
CO2(g)+H2(g);K2
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g);K=___________(用含K1、K2的代数式表示)。
CO2(g)+4H2(g);K=___________(用含K1、K2的代数式表示)。
②T1温度时,对于反应:CO(g)+ H2O(g)![]() CO2(g)+ H2(g),向2 L的恒容密闭容器中通入一定量的CO和H2O(g)。若达到平衡后,反应放热Q kJ,保持其他条件不变,只是向原平衡体系中再通入0.20 mol H2O(g),则下列说法正确的是_____________。
CO2(g)+ H2(g),向2 L的恒容密闭容器中通入一定量的CO和H2O(g)。若达到平衡后,反应放热Q kJ,保持其他条件不变,只是向原平衡体系中再通入0.20 mol H2O(g),则下列说法正确的是_____________。
a.CO的转化率将增大 b.达到新平衡时的反应热ΔH > —Q
c.气体的密度将不变 d.H2O的体积分数增大
(2)将3 molH2和2 molN2充入某恒温恒压容器中,发生合成氨的反应:3H2(g) +N2(g) ![]() 2NH3(g),达平衡时NH3的浓度为c mol·L-1。保持温度不变,按下列配比分别充入该容器,平衡后NH3的浓度不为c mol·L-1的是_________。
2NH3(g),达平衡时NH3的浓度为c mol·L-1。保持温度不变,按下列配比分别充入该容器,平衡后NH3的浓度不为c mol·L-1的是_________。
a.6 molH2 + 4 molN2
b.0.75 molH2 + 0.75 molN2 + 0.5 molNH3
c.3 molH2+ 1 molN2 + 2 mol NH3
(3)H2O2作为氧化剂在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题:
①定性图甲可通过观察产生气泡的快慢的定性分析比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液,你认为___________,(填合理或不合理)
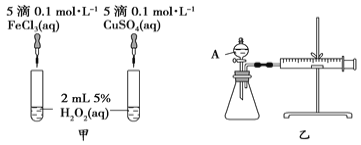
②定量如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。检查该装置气密性的方法是:关闭A的活塞,将注射器活塞向外拉出一段后松手,过一段时间后看__________,实验中需要测量的数据是_________________。
【答案】K1·K2 ad c 合理 注射器活塞是否复原 生成40mL气体所需要的时间
【解析】
(1)①根据化学平衡常数的表达式分析;
②根据浓度对化学平衡的影响分析;
(2)根据恒温恒压下等效平衡的规律分析;
(3)比较不同催化剂对双氧水分解的催化效果时,采用控制变量法,排除阴离子的干扰;比较反应速率快慢,需测收集40mL气体所用时间。
(1)①a.CH4(g)+H2O(g)![]() CO(g)+3H2(g);K1 ①
CO(g)+3H2(g);K1 ①
b.CO(g)+H2O(g)![]() CO2(g)+H2(g);K2 ②
CO2(g)+H2(g);K2 ②
将①+②得:CH4(g)+2H2O(g) ![]() CO2(g)+4H2(g);
CO2(g)+4H2(g);
K=![]() =K1·K2,
=K1·K2,
答案为:K1·K2。
②a.向原平衡体系中再通入0.20 mol H2O(g),平衡正向移动,CO的转化率将增大,a正确;
b.向原平衡体系中再通入0.20 mol H2O(g),平衡正向移动,放出的热量增多,但达到新平衡时的反应热ΔH不变,b错误;
c.体积不变,但气体的质量增大,所以气体的密度将增大,c错误;
d.加入H2O,虽然平衡正向移动,但H2O的体积分数增大,d正确。
答案为:a d
(2)a.6 molH2 + 4 molN2,与3 molH2和2 molN2属于恒温恒压下的等效平衡,平衡后NH3的浓度为c mol·L-1;
b.将生成物全部转化为反应物,即为1.5 molH2 + 1 molN2,与3 molH2和2 molN2属于恒温恒压下的等效平衡,平衡后NH3的浓度为c mol·L-1;
c.将生成物全部转化为反应物,即为6molH2+ 2molN2,与3 molH2和2 molN2不属于等效平衡,平衡后NH3的浓度不为c mol·L-1;
答案为:c。
(3)①FeCl3溶液和CuSO4溶液不仅阳离子不同,而且阴离子不同,所以对H2O2分解速率的影响可能是阴离子不同引起的,为了探究阳离子不同对反应速率的影响,应控制阴离子相同,将FeCl3改为Fe2(SO4)3溶液合理;答案为:合理。
②检查该装置气密性的方法是:关闭A的活塞,将注射器活塞向外拉出一段后松手,若装置不漏气,则导致锥形瓶压强减小,过一段时间后就会恢复原状;要比较催化效果,一种方法是可以看相同时间内产生的气体量,另一种方法是看产生相同量的气体所需的时间。对于此题来说,实验中需要测量的数据是生成40mL气体所需要的时间。
答案为:注射器活塞是否复原;生成40mL气体所需要的时间。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )

A. a、c两点的反应速率:a>c
B. a、c两点气体的颜色:a深,c浅
C. b、c两点的转化率:b>c
D. 由b点到a点,可以用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋及其化合物在工业生产中用途广泛,某研究小组用浮选过的辉铋矿![]() 主要成分是
主要成分是![]() ,还含少量
,还含少量![]() 等杂质
等杂质![]() 制备
制备![]() ,其流程如下:
,其流程如下:

已知:![]() 水解能力:
水解能力:![]()
![]() 。
。
回答下列问题:
(1)“浸取”时,为了提高浸取速率,可采取的措施有___________![]() 任写一条
任写一条![]() ;过滤1的滤渣的主要成分有______________
;过滤1的滤渣的主要成分有______________![]() 填化学式
填化学式![]() 。
。
(2)浸取时加入过量浓盐酸的目的是____________________________________。
(3)写出焙烧时生成铋酸钠的化学方程式_________________________________。
(4)![]() 时,向浓度均为
时,向浓度均为![]() 的
的![]() 、
、![]() 的混合溶液中滴加
的混合溶液中滴加![]() 溶液
溶液![]() 设溶液体积增加1倍
设溶液体积增加1倍![]() ,当
,当![]() 时恰好完全沉淀,判断此时
时恰好完全沉淀,判断此时![]() 是否已经开始沉淀________
是否已经开始沉淀________![]() 填“是”或“否”
填“是”或“否”![]() 已知:
已知:![]() 、
、![]()
(5)用双硫腙![]() ,二元弱酸
,二元弱酸![]() 络合萃取法可从工业废水中提取金属离子:
络合萃取法可从工业废水中提取金属离子:![]() 先将金属离子络合成电中性的物质
先将金属离子络合成电中性的物质![]() 如
如![]() 等
等![]() ,再用
,再用![]() 萃取此络合物。下图是用上述方法处理含有
萃取此络合物。下图是用上述方法处理含有![]() 、
、![]() 、
、![]() 的废水时的酸度曲线
的废水时的酸度曲线![]() 表示金属离子以络合物形式被萃取分离的百分率
表示金属离子以络合物形式被萃取分离的百分率![]() 。
。

![]() 当调节
当调节![]() 时,铋
时,铋![]() 的存在形式为____________。
的存在形式为____________。
![]() 向萃取后的
向萃取后的![]() 中加入过量NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为____。
中加入过量NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)钛原子的价电子排布式为______________________,TiCl4沸点136℃,熔点-25℃,晶体类型为___________晶体。
(2)铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是______________________。
(3)与As同主族的短周期元素是N、P。AsH3中心原子轨道杂化的类型_________________;一定压强下将AsH3、NH3和PH3的混合气体降温时液化顺序是______________________,理由是______________________。
(4)铬是一种硬而脆抗腐蚀性强的金属,常用于电镀和制造特种钢。下图1为铬的晶胞结构图,则铬晶胞属于___________堆积;该晶胞中原子的体积占晶胞体积的百分率为___________。

(5)钴晶体的一种晶胞(如图2所示)的边长为anm,密度为ρg·cm-3,NA表示阿伏加德罗常数的值,则钴原子半径为___________mm,钴的相对原子质量可表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体缺乏维生素A,会出现皮肤干燥、夜盲症等症状。维生素A又称视黄醇,分子结构如下图所示,下列说法正确的是
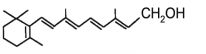
A. 1mol维生素A最多能与7molH2发生加成反应
B. 维生素A不能被氧化得到醛
C. 维生素A是一种易溶于水的醇
D. 维生素A的分子式为C20H30O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是硼镁矿生产硼砂晶体![]() 时的废渣,其主要成分是MgO,还含有
时的废渣,其主要成分是MgO,还含有![]() 、CaO、
、CaO、![]() 、FeO、MnO、
、FeO、MnO、![]() 等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:
等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:
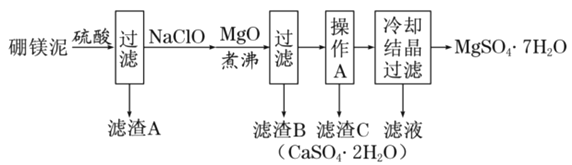
回答下列问题:
(1)![]() 中B的化合价为__________。
中B的化合价为__________。
(2)![]() 易溶于水,也易发生水解:
易溶于水,也易发生水解:![]() 硼酸
硼酸![]() 硼酸在常温下溶解度较小
硼酸在常温下溶解度较小![]() 。写出加入硫酸时
。写出加入硫酸时![]() 发生反应的化学方程式:_____。
发生反应的化学方程式:_____。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式____________。
(4)加入MgO的目的是___________________。
(5)已知![]() 、
、![]() 的溶解度如下表:
的溶解度如下表:
温度 | 40 | 50 | 60 | 70 |
|
|
|
|
|
|
|
|
|
|
“操作A”是将![]() 和
和![]() 混合溶液中的
混合溶液中的![]() 除去,根据上表数据,简要说明“操作A”步骤为____________________。
除去,根据上表数据,简要说明“操作A”步骤为____________________。
(6)硼砂也能在工业上制取![]() ,
,![]() 被称为有机化学中的“万能还原剂”。
被称为有机化学中的“万能还原剂”。
![]() 写出
写出![]() 的电子式:___________。
的电子式:___________。
![]() “有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克
“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克![]() 的还原能力。
的还原能力。![]() 的有效氢含量为_________
的有效氢含量为_________![]() 保留两位小数
保留两位小数![]() 。
。
![]() 在碱性条件下,在阴极上电解
在碱性条件下,在阴极上电解![]() 也可制得硼氢化钠,写出阴极室的电极反应式:________。
也可制得硼氢化钠,写出阴极室的电极反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】诺卜醇可用于调制木香型化妆品及皂用香精,诺卜醇的一种制备方法如图所示。下列说法正确的是( )
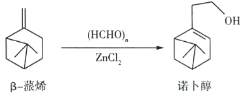
A.可用溴的![]() 溶液区别β-蒎烯与诺卜醇
溶液区别β-蒎烯与诺卜醇
B.β-蒎烯的饱和碳原子上的一氯代物最多有7种
C.β-蒎烯和诺卜醇分子中都有一个由5个碳原子构成的四面体
D.可用酸性高锰酸钾溶液鉴别β-蒎烯和诺卜醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,答下列问題:
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2该反应氧化剂与还原剂物质的量之比为_______________。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
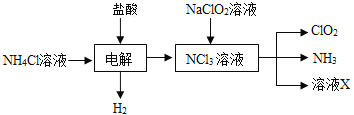
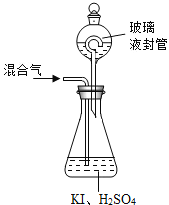
图1 图2
①电解时发生反应的化学方程式为_______________________________________________ 。
②溶液X中大量存在的阴离子有________________________________________________ 。
③除去ClO2中的NH3可选用的试剂是 ___________________(填标号)。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
(3)用上图2装置可以测定混合气中ClO2的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入 3 mL 稀硫酸:
Ⅱ.在玻璃液封装置中加入水.使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为_______________________________。
②玻璃液封装置的作用是________________________________________________。
③V中加入的指示剂通常为___________,滴定至终点的现象是_________________________。
④测得混合气中ClO2的质量为____________________________ g.。
(4)O2处理过的饮用水会含有一定最的亚氯酸盐。若要除去超标的亚氯酸盐,下列物庾最适宜的是________(填标号)。
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是天然气的主要成分,以A为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。已知烃B在标准状况下的密度为1.06g·L-1,C能发生银镜反应,F为有浓郁香味,不易溶于水的油状液体。
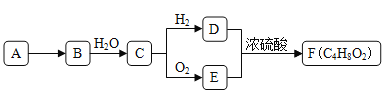
请回答:
(1)有机物D中含有的官能团名称是__________________。
(2) D+E→F的反应类型是_________________________。
(3)有机物A在高温下转化为B的化学方程式是_________________。
(4)下列说法正确的是___。
A.有机物E与金属钠反应比水与金属钠反应要剧烈
B.有机物D、E、F可用饱和Na2CO3溶液鉴别
C.实验室制备F时,浓硫酸主要起氧化作用
D.有机物C能被新制碱性氢氧化铜悬浊液、酸性KMnO4溶液氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com