


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
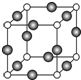 已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大.元素X是周期表中原子半径最小的元素;Y的基态原子价电子构型为:nsnnpn;钠在W的单质中燃烧生成淡黄色固体;K位于ds区且原子的最外层电子数与X的相同.请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大.元素X是周期表中原子半径最小的元素;Y的基态原子价电子构型为:nsnnpn;钠在W的单质中燃烧生成淡黄色固体;K位于ds区且原子的最外层电子数与X的相同.请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C |
①能使溴的四氯化碳溶液褪色; ②比例模型为: 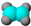 ③能与水在一定条件下反应生成C |
①由C、H两种元素组成; ②球棍模型为: 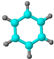 |
①由C、H、O三种元素组成; ②能与Na反应; ③其相对分子质量为46. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | |||||
| ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④ | B、①②④ |
| C、②④ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在FeCl3溶液中滴加NaOH溶液可生成氢氧化铁胶体 |
| B、胶体粒子直径在1-100nm之间 |
| C、胶体具有介稳性,不能透过滤纸 |
| D、用丁达尔现象无法区别CuSO4溶液与Fe(OH)3胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com