
| 2.24L |
| 22.4L/mol |
| 0.1mol×3 |
| 2 |
| 1.6g |
| 64g/mol |


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
A、NH4+:试液
| |||||
B、I-:试液
| |||||
C、HCO3-:试液
| |||||
D、Fe2+:试液
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
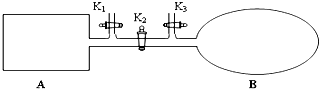 如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,将各1mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L.
如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,将各1mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知1-丙醇和2-丙醇的结构简式如图:
已知1-丙醇和2-丙醇的结构简式如图: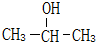
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
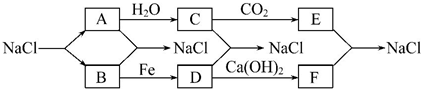
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com