
【题目】9.03×1023个CH4中,含____mol碳原子,____mol氢原子,____mol质子,____mol电子。与____个NH3含有相同数目的氢原子。标准状况下CH4所占的体积为_____。
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】(1)下列气态分子BCl3、CCl4、H2O和BeCl2中,其键角由大到小的顺序为________。
(2)硫化氢(H2S)分子的空间构型为________;二氧化碳(CO2)分子的空间构型为________;甲烷(CH4)分子的空间构型为________。
(3)由于氨水和次氯酸盐溶液在弱碱性介质中反应可生成氯胺(H2NCl),分子结构类似于NH3,H2NCl分子的空间构型为________,电子式为________,H2NCl中氯的化合价为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含有大量PbI2的饱和溶液中存在平衡:PbI2(s)![]() Pb2+(aq)+2I-(aq),向该饱和溶液中加入KI浓溶液,下列说法正确的是
Pb2+(aq)+2I-(aq),向该饱和溶液中加入KI浓溶液,下列说法正确的是
A. 溶液中Pb2+和I-的浓度都增大 B. PbI2的溶度积常数Ksp增大
C. 沉淀溶解平衡向右移动 D. 溶液中Pb2+的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容密闭容器中,发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH。其平衡常数(K)和温度(T)的关系如下表:
CO(g)+H2O(g) ΔH。其平衡常数(K)和温度(T)的关系如下表:
T℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
试回答下列问题:
(1)上述反应为____(填“放热”或“吸热”)反应,升高温度,平衡向______ (填“正反应”或“逆反应”) 方向移动。
(2)某温度下,在体积为2L的恒容密闭容器中通入2molCO2(g)和4molH2(B)发生上述应,5min时反应达到平衡,测得CO2(g)的转化率是75%。
①v(H2O)=______mol·L-1·min-l。
②该温度下反应的平衡常数K=______.
(3)生产水煤气的过程如下:
①C(s)+CO2(g) ![]() 2CO(g)ΔH1
2CO(g)ΔH1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2
CO2(g)+H2(g) ΔH2
③反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=________ (用含ΔH1、ΔH2的代数式表示)。
CO(g)+H2O(g) ΔH=________ (用含ΔH1、ΔH2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯磺酰氰酯(结构简式为 )是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
)是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
(1)基态钴原子的核外电子排布式为________________。组成HClO4-NaClO4的4种元素的电负性由小到大的顺序为____________________。
(2)氯磺酰氰酯分子中硫原子和碳原子的杂化轨道类型分别是____________、___________, 1个氯磺酰氰酯分子中含有σ键的数目为______________,氯磺酰氰酯中5种元素的第一电离能由大到小的顺序为_________________。
(3)ClO4-的空间构型为__________________。
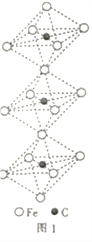
(4)一种由铁、碳形成的间隙化合物的晶体结构如图1所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为________________。
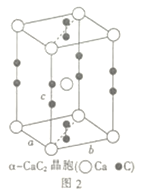
(5)电石(CaC2)是制备氯化氰(ClCN)的重要原料。四方相碳化钙(CaC2)的晶胞结构如上图2所示,其晶胞参数分别为a、b、c,且a=b,c=640pm。已知四方相碳化钙的密度为1.85g·cm-3,[C≡C]2-中键长为120pm,则成键的碳原子与钙原子的距离为________pm和_______pm。(设阿伏加德罗常数的数值为6×1023)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印染工业常用亚氯酸钠(NaClO2)漂白织物。用过氧化氢法生产亚氯酸钠的工艺流程如下:
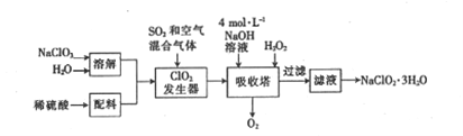
已知:①NaClO2的溶解度随温度的升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②Ksp(FeS)=6.3×10-18;Ksp(CuS)= 6.3×10-36;Ksp(PbS)=2.4×10-28。
(1)发生器中反应的还原剂是_________(填化学式,下同)。吸收塔内ClO2在碱性条件下与H2O2生成NaClO2 的离子方程式为_______
(2)从滤液中得到的NaClO2·3H2O的操作依次是_______、(填字母)、洗染、干燥。
a.蒸馏 b.灼烧 c.冷却结晶 d.蒸发浓缩 e.过滤
(3)亚氯酸钠漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数。
弱酸 | HClO2 | HF | HCN | H2S |
Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
①常温下,物质的量浓度相同的NaF、NaCN 两种溶液的PH由大到小的顺序为________。
②等体积等物质的量浓度的HClO2与NaOH溶液充分反应后,溶液中各离子浓度由大到小的顺序为_____。
③Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+,滴加Na2S溶液后最先析出的沉淀是______;当最后一种离子沉淀完全时(该离子浓度为10-5 mol·L-l),此时体系中S2-的浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有NaCl、NaOH、AgNO3三种溶液,只用一种试剂就可把它们鉴别开来,该试剂是( )
A.FeCl3溶液
B.Na2CO3溶液
C.MgCl2溶液
D.盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某碳酸钠样品中含有少量氯化钠杂质,为测定该样品中碳酸钠的质量分数,进行了如下实验:

请回答下列问题:
(1)操作A用到的玻璃仪器除烧杯外还必需有_______________、_______________;
(2)在实验过程中加入饱和石灰水后发生反应的离子方程式是_____________________。
(3)为探究上述反应后滤液中的溶质成分,甲同学向滤液中滴加过量稀盐酸,发现无气泡产生,说明滤液中一定不含 _________________(填溶质的化学式,下同),若有气泡产生,那么测定的样品中碳酸钠的质量分数___________(填偏大、偏小、无影响)。
(4)在(3)探究中,滴加盐酸前滤液中的溶质除氯化钠外,一定还含有的溶质是________;滴加盐酸的过程中一定发生反应的离子方程式为 ___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com