
【题目】(1)科学家发现某药物M能治疗血管疾病,是因为它在人体内能释放出一种“信使分子”D,已知M的相对分子质量为227,由C、H、O、N四种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%,则M的分子式是________________。D是双原子分子,相对分子质量为30,则D的分子式为________________。
(2)油脂A经下列途径可得到M:

图中②的提示:R—OH+HO—NO2![]() R—O—NO2+H2O(R代表烃基),反应②的化学方程式为___________________________________。
R—O—NO2+H2O(R代表烃基),反应②的化学方程式为___________________________________。
(3)C是B和乙酸在一定条件下反应生成的化合物,相对分子质量为134,写出C所有可能的结构简式___________________________________。
(4)若将0.1 mol B与足量的金属钠反应,则需消耗________ g金属钠。
【答案】C3H5O9N3NO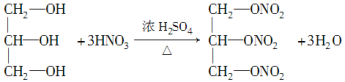
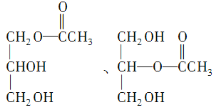 6.9
6.9
【解析】
试题本题考查有机物分子式的确定,油脂的水解,有机方程式的书写,符合条件的有机物结构简式的书写,醇与Na反应的计算。
(1)1个M分子中N(C)=227![]() 15.86%
15.86%![]() 12=3,N(H)=227
12=3,N(H)=227![]() 2.20%
2.20%![]() 1=5,N(N)227
1=5,N(N)227![]() 18.50%
18.50%![]() 14=3,N(O)=(227—12
14=3,N(O)=(227—12![]() 3—1
3—1![]() 5—14
5—14![]() 3)
3)![]() 16=9,所以M的分子式为C3H5O9N3。“信使分子”的相对分子质量为30,为双原子分子,D为NO。
16=9,所以M的分子式为C3H5O9N3。“信使分子”的相对分子质量为30,为双原子分子,D为NO。
(2)油脂是高级脂肪酸甘油酯,经水解得到高级脂肪酸和甘油,则B为甘油,B的结构简式为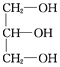 ,B属于三元醇,反应②为甘油和HNO3按照给出的提示发生酯化反应生成M,反应的化学方程式为:
,B属于三元醇,反应②为甘油和HNO3按照给出的提示发生酯化反应生成M,反应的化学方程式为: +3HO—NO2
+3HO—NO2![]()
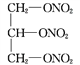 +3H2O。
+3H2O。
(3)B的相对分子质量为92,乙酸的相对分子质量为60,C的相对分子质量为134,C与B的相对分子质量相差134-92=42,则C是B与乙酸以物质的量之比1:1反应生成的酯,C可能的结构简式为: 、
、 。
。
(4)因为B中含3个醇羟基,所以0.1 mol B要消耗0.3molNa,消耗Na的质量为0.3mol![]() 23g/mol=6.9g。
23g/mol=6.9g。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】研究性学习小组用高锰酸钾粉末与浓盐酸制取氯气,并验证其性质。

(资料在线)高锰酸钾粉末与浓盐酸混合即产生氯气。
请回答下列问题:
(1)该实验中A部分的装置应选用下图中的______(填序号)

(2)实验中A发生反应的离子方程式是_________。
(3)一段时间后D中的现象为_________。
(4)请你设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤) _________。
(5)图(1)整套实验装置存在的明显缺陷是_________。
(6)图(2)装置a处通入氯气,证明氯气是否具有漂白性,该设计能否达到实验目的? _________ (填“能”或“不能”)。若能请说明理由,若不能则提出改进的措施_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应X+2Y→R+2M 中,已知R和M的摩尔质量之比为22:9,当1.6克X与Y恰好完全反应后,生成4.4克R,则Y与M的质量依次为_____________,解答此题时使用到的化学定律是_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志,F是一种常见的高分子材料。根据下面转化关系回答下列问题:

(1)操作⑥、操作⑦的名称分别为________、________。
(2)下列物质中沸点最高的是________。
A 汽油 B 煤油
C 柴油 D 重油
(3)在①~⑤中属于取代反应的是________;原子利用率为100%的反应是________。(填序号)
(4)写出结构简式:A________、F________。
(5)写出反应③的离子方程式:___________。
(6)作为家庭中常见的物质F,它给我们带来了极大的方便,同时也造成了环境污染,这种污染称为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年我国大面积发生雾霾天气,其主要原因是SO2、NOx等挥发性有机物等发生二次转化,研究碳、氮、硫及其化合物的转化对于环境的改善有重大意义。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g) ![]() CO2(g)+2H2O(g)+N2 (g) △H=_____kJ·mol-1;该反应在_____(高温,低温,任何温度)下可自发进行
CO2(g)+2H2O(g)+N2 (g) △H=_____kJ·mol-1;该反应在_____(高温,低温,任何温度)下可自发进行
(2)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为: 2SO2(g)+O2(g) ![]() 2SO3(g) △H< 0,在一定温度下的定容容器中,能说明上述平衡达到平衡状态的是:_______________。
2SO3(g) △H< 0,在一定温度下的定容容器中,能说明上述平衡达到平衡状态的是:_______________。
A. 混合气体的密度不再发生变化 B.混合气体的平均摩尔质量不再发生变化
C. v(SO2):v(O2):v(SO3)=2:1:2 D.混合气体的总物质的量不再发生变化
(3)若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强与反应时间如下图所示。

①图中A点时,SO2的转化率为________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正)_____v A(逆) (填“>"、“<”或“ = ”)。
③图中B点的平衡常数Kp=______。(Kp=压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压物质的量分数)
(4)为了清除NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理。现有由a mol NO、b molNO2、c molN2O4组成的混合气体恰好被VL氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
A. 2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ΔH=-2b kJ·mol-1
4CO2(g)+2H2O(l) ΔH=-2b kJ·mol-1
B. 2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(g) ΔH=-4b kJ·mol-1
4CO2(g)+2H2O(g) ΔH=-4b kJ·mol-1
C. 2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ΔH=-4b kJ·mol-1
4CO2(g)+2H2O(l) ΔH=-4b kJ·mol-1
D. 2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ΔH=+4b kJ·mol-1
4CO2(g)+2H2O(l) ΔH=+4b kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志,F是一种常见的高分子材料。根据下面转化关系回答下列问题:

(1)操作⑥、操作⑦的名称分别为________、________。
(2)下列物质中沸点最高的是________。
A 汽油 B 煤油
C 柴油 D 重油
(3)在①~⑤中属于取代反应的是________;原子利用率为100%的反应是________。(填序号)
(4)写出结构简式:A________、F________。
(5)写出反应③的离子方程式:___________。
(6)作为家庭中常见的物质F,它给我们带来了极大的方便,同时也造成了环境污染,这种污染称为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH > 0
B.已知2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1,则CO的燃烧热ΔH=-283 kJ
C.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则稀H2SO4溶液和稀Ba(OH)2 溶液反应的反应热ΔH ==2×(-57.3) kJ·mol-1
D.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6 kJ·mol-1
2NH3(g) △H=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为![]() 的密闭容器内,物质
的密闭容器内,物质![]() 在
在![]() ℃时发生反应,其反应物和生成物的物质的量随时间
℃时发生反应,其反应物和生成物的物质的量随时间![]() 的变化关系如图,下列叙述不正确的是( )
的变化关系如图,下列叙述不正确的是( )
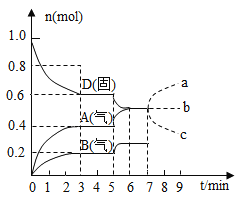
A. 若在第7分钟时增加![]() 的物质的量,则表示
的物质的量,则表示![]() 的物质的量变化正确的是a曲线
的物质的量变化正确的是a曲线
B. 该反应的化学方程式为![]() ,该反应的平衡常数表达式为
,该反应的平衡常数表达式为![]()
C. 已知反应的![]() ,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
D. 从反应开始到第一次达到平衡时,![]() 物质的平均反应速率为
物质的平均反应速率为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com