
分析 (1)由①2H2(g)+O2(g)═2H2O(l)△H=-283.0 kJ/mol;
②2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(l)△H=-726.0 kJ/mol;
根据盖斯定律:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=$\frac{3①-②}{2}$,进行计算求解;
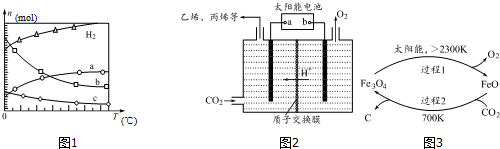
(2)由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热;可知a为CO2的变化曲线,结合计量数关系可知b为水,c为C2H4的变化曲线;
(3)太阳能电池为电源,电解强酸性的二氧化碳水溶液得到丙烯,丙烯在阴极生成.据此解答;
(4)①由示意图可知,过程1中四氧化三铁在大于2300K条件下分解生成氧化亚铁和碳,据此解答即可;
②反应2Fe3O4$\frac{\underline{\;2300K\;}}{\;}$6FeO+O2↑中O元素化合价由-2价升高到0价,结合元素化合价以及方程式计算.
解答 解:(1)由①2H2(g)+O2(g)═2H2O(l)△H=-283.0 kJ/mol;
②2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(l)△H=-726.0 kJ/mol;
根据盖斯定律:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=$\frac{3①-②}{2}$=$\frac{3×(-283.0)-(-726.0)}{2}$=-61.5 kJ/mol,
故答案为:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-61.5 kJ/mol;
(2)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,Q<0,
故答案为:<;
②随着温度升高,氢气的物质的量逐渐增多,因氢气为反应物,则另一条逐渐增多的曲线为CO2,由计量数关系可知b为水,c为C2H4的变化曲线,故答案为:H2O;
(3)①太阳能电池为电源,电解强酸性的二氧化碳水溶液得到乙烯,可知能量转化形式有光能转化为电能,电能转化为化学能,部分电能转化为热能,故答案为:太阳能转化为电能,电能转化为化学能;
②电解时,二氧化碳在b极上生成丙烯,得到电子的一极为电源的正极,电极反应式为:3CO2+18H++18e-=C3H6+6H2O,
故答案为:正;3CO2+18H++18e-=C3H6+6H2O;
(4)①由示意图可知,过程1中四氧化三铁在大于2300K条件下分解生成氧化亚铁和碳,反应的化学方程式为:2Fe3O4$\frac{\underline{\;2300K\;}}{\;}$6FeO+O2↑,
故答案为:2Fe3O4$\frac{\underline{\;2300K\;}}{\;}$6FeO+O2↑;
②反应2Fe3O4$\frac{\underline{\;2300K\;}}{\;}$6FeO+O2↑中O元素化合价由-2价升高到0价,由方程式可知,2molFe3O4参加反应,生成1mol氧气,转移4mol电子,则每分解lmolFe3O4转移电子的物质的量为2mol,
故答案为:2mol.
点评 本题涉及热化学方程式书写和盖斯定律计算、氧化还原、化学平衡移动以及原电池反应等知识,考查了学生分析问题、解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:选择题
反应A(g)+3B(g) 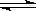 2C(g)+2D(g), 在四种不同情况下的反应速率, 其中反应速率最大的是
2C(g)+2D(g), 在四种不同情况下的反应速率, 其中反应速率最大的是
A.v(D) = 24mol·L-1·min-1
B.v(C) = 0.5mol·L-1·s-1
C.v(B) = 30mol·L-1·min-1
D.v(A) = 0.15 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
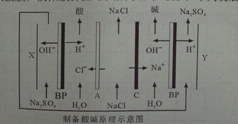
| A. | A为阳离子交换膜,C为阴离子交换膜 | |
| B. | X为阴极,发生的电极反应方程式为:4OH--4e-=O2↑+2H2O | |
| C. | 在X、Y极室加入Na2SO4,目的是提供制备的酸和碱的阳离子或阴离子 | |
| D. | 通过该装置,不但海水得到了淡化,同时还可以得到NaOH、HCl、H2、O2等物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

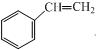
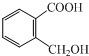
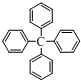
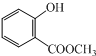
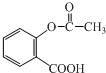
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
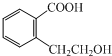
| A. | 分子中C、H、O的个数比为1:2:3 | B. | 分子中C、H的个数比为1:2 | ||
| C. | 该有机物的分子量为14 | D. | 该分子中肯定不含氧元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com