
| A. | 5g H2 和 5g O2 | B. | 标况下 5.6L N2和 22g CO2 | ||
| C. | 32 g SO2和0.5molH2 | D. | 44.8 L CO和2NA个O3分子 |
分析 所含分子数相等,说明两种物质的物质的量相等,根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$计算其物质的量来判断即可.
解答 解:所含分子数相等,说明两种物质的物质的量相等,
A.根据n=$\frac{m}{M}$知,两种气体的质量相等但摩尔质量不等,所以其物质的量不等,所以分子数不等,故A错误;
B.标况下氮气物质的量=$\frac{V}{{V}_{m}}$=$\frac{5.6L}{22.4L/mol}$=0.25mol,22g CO2物质的量0.5mol,所以二者分子数不相等,故B错误;
C.32g二氧化硫物质的量=$\frac{32g}{64g/mol}$=0.5mol,所以二者分子数相等,故C正确;
D.标况下,44.8 二氧化碳物质的量为2mol,2NA个O3分子物质的量为2mol,而状况不知,故D错误;
故选C.
点评 本题考查物质的量的计算,侧重考查分析计算能力,明确物质的量公式中各个物理量的关系即可解答,注意气体摩尔体积适用范围及适用条件,题目难度不大.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 含有0.1mol•L-1Fe3+的溶液中:K+、Mg2+、I-、NO3- | |
| B. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、CO32- | |
| C. | 含有0.1mol•L-1Ca2+的溶液中:Na+、K+、CO32-、Cl- | |
| D. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25.6g | B. | 24.4g | C. | 24.6g | D. | 262g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③④ | C. | ②④⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
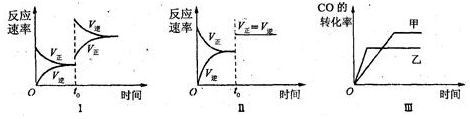
| A. | 图Ⅱ研究的只是t0时使用催化剂对反应速率的影响 | |
| B. | 图Ⅰ研究的是t0时缩小容器体积对反应速率的影响 | |
| C. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 | |
| D. | 图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| B. | 高压比常压有利于由SO2和氧气合成SO3的反应 | |
| C. | 红棕色的NO2,加压后颜色先变深后变浅 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 干法 | Fe2O3、KNO3、KOH 混合加热共熔生成紫红色 K2FeO4 和 KNO2 等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3和 KClO 反应生成紫红色 K2FeO4溶液 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com