
| A. | 乙烯通入酸性高锰酸钾溶液,发生取代反应 | |
| B. | 向试管中加入2mL5%硫酸铜溶液,再滴加几滴稀氢氧化钠溶液,混匀,立即加入2mL10%葡萄糖溶液,在酒精灯上加热至沸腾,可看到红色沉淀 | |
| C. | 用蒸馏法分离乙酸乙酯和饱和碳酸钠溶液 | |
| D. | 煤的干馏、煤的气化、石油裂化是化学变化,石油的分馏是物理变化 |
分析 A、乙烯中含有不饱和双键,能与高锰酸钾发生氧化反应;
B、该反应必须在碱性条件下进行;
C、乙酸乙酯不溶于饱和碳酸钠溶液;
D、煤的干馏是指煤在隔绝空气的条件下加热,生成其它新物质.石油分馏是指通过石油中含有的物质的沸点不同而使各种物质分离开的一种方法,该过程中没有新物质生成.
解答 解:A、乙烯与高锰酸钾溶液发生的是氧化反应,故A错误;
B、葡萄糖和氢氧化铜悬浊液的反应必须在碱性条件下进行;向试管中加入2mL5%硫酸铜溶液,再滴加几滴稀氢氧化钠溶液,该混合液是酸性溶液,所以没有红色沉淀生成,故B错误;
C、乙酸乙酯不溶于饱和碳酸钠溶液,应用分液的方法分离,故C错误;
D、煤的干馏是指煤在隔绝空气的条件下加热,生成煤焦油、焦炭、焦炉煤气等物质,属于化学变化.石油分馏是指通过石油中含有的物质的沸点不同而使各种物质分离开的一种方法,该过程中没有新物质生成,属于物理变化,故D正确,故选D.
点评 本题考查了煤的干馏和石油的分馏、取代反应等知识点,难度不大,易错选项是B,注意葡萄糖和氢氧化铜悬浊液的反应必须在碱性条件下进行,否则看不到红色沉淀.


科目:高中化学 来源: 题型:解答题

| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的pH值 | 3.2 | 5.2 | 10.4 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰醋酸与食用醋有相同的气味 | |
| B. | 乙烯、氯乙烯、苯乙烯都可用于合成有机高分子材料 | |
| C. | 苯能与溴发生反应,因此不能用苯萃取溴水中的溴 | |
| D. | 淀粉和纤维素水解的最终产物都是葡萄糖,因此二者互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
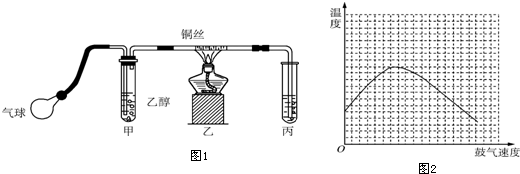
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
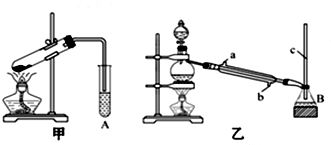
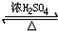 HCO18OCH3+H2O.
HCO18OCH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O与D2O属同系物 | |
| B. | 35Cl与37Cl属同素异形体 | |
| C. | O2与O3属同位素 | |
| D. | 乙醇与二甲醚(CH3-O-CH3)属同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
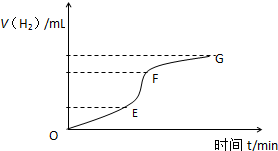 用纯净的锌粒与稀盐酸反应制取氢气,请回答:
用纯净的锌粒与稀盐酸反应制取氢气,请回答:| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com