
二甲醚(CH3OCH3)被称为21世纪界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)⇌CH3OH(g)△H1=﹣90.7kJ•mol﹣1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=﹣23.5kJ•mol﹣1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=﹣41.2kJ•mol﹣1
(1)若要增大反应①中H2的转化率,在其它条件不变的情况下可以采取的措施为 .
A.加入某物质作催化剂 B.加入一定量CO C.反应温度降低 D.增大容器体积
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L,c(H2)=2mol/L,5min后达到平衡,CO的转化率为50%,则5min内CO的平均反应速率为 ;
若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2mol/L,
a= mol/L.
(3)催化反应室中总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)的△H= ﹣.
考点:
化学平衡的影响因素;用盖斯定律进行有关反应热的计算;化学平衡的计算.
分析:
(1)已知反应①是体积减小的放热反应,根据外界条件对平衡的影响分析;
(2)5min后达到平衡,CO的转化率为50%,则△c(CO)=1mol/L×50%=0.5mol/L,根据v(CO)=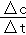 计算v(CO);
计算v(CO);
计算该温度下的平衡常数,根据平衡常数计算平衡时氢气的浓度,根据甲醇的平衡浓度计算氢气浓度的变化量,进而计算a的值;
(3)根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减.
解答:
解:(1)已知反应①是体积减小的放热反应,若要增大反应①中H2的转化率,则需要使平衡正移,所以改变的条件为加入一定量CO或反应温度降低;
故答案为:BC;
(2)5min后达到平衡,CO的转化率为50%,则△c(CO)=1mol/L×50%=0.5mol/L,所以v(CO)= =0.1mol/(L•min);
=0.1mol/(L•min);
该温度到达平衡时,c(CO)=0.5mol/L,c(H2)=2.4mol/L﹣2×0.5mol/L=1.4mol/L,c(CH3OH)=0.5mol/L,所以该温度下,平衡常数k= =
= ,若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2mol/L,则平衡时c′(CO)=4mol/L﹣2mol/L=2mol/L,令平衡时氢气的浓度为ymol/L,所以
,若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2mol/L,则平衡时c′(CO)=4mol/L﹣2mol/L=2mol/L,令平衡时氢气的浓度为ymol/L,所以 =
=
解得y=1.4,故a=2mol/L×2+1.4mol/L=5.4mol/L.
故答案为:0.1mol/(L•min);5.4.
(3)已知:①CO(g)+2H2(g)⇌CH3OH(g)△H=﹣90.7kJ/mol,
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=﹣23.5kJ/mol,
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=﹣41.2kJ/mol,
由盖斯定律可知,①×2+②+③得3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)△H=﹣246.1kJ/mol,
故答案为:﹣246.1kJ/mol.
点评:
本题考查热化学方程式书写,燃烧热概念,平衡移动,图象分析应用,原电池电极反应的书写方法,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
某一反应物的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,在这20s内它的反应速率为( )
|
| A. | 0.04 | B. | 0.04mol/(L•s) | C. | 0.08mol/(L•s) | D. | 0.04mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应A2(g)+2B2(g)⇌2AB2(g)(正反应放热),下列说法正确的( )
|
| A. | 升高温度,正向反应速率减小,逆向反应速率增加 |
|
| B. | 升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
|
| C. | 达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
|
| D. | 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将纯水加热至较高温度,下列叙述正确的是( )
|
| A. | 水的离子积变大、pH变小、呈酸性 |
|
| B. | 水的离了积不变、pH不变、呈中性 |
|
| C. | 水的离子积变小、pH变大、呈碱性 |
|
| D. | 水的离子积变大、pH变小、呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在容积固定的密闭容器中进行可逆反应:2NO2⇌2NO+O2,达到平衡的标志是( )
①相同时间内,氧气的生成速率为n mol•L﹣1•s﹣1,NO2的生成速率为2n mol•L﹣1•s﹣1
②单位时间内生成n mol O2的同时生成2n mol的NO
③混合气体的颜色不再变化
④混合气体的密度保持不变
⑤混合气体的平均相对分子质量不再改变
⑥压强不随时间变化而变化.
|
| A. | ①③⑤⑥ | B. | ②③⑤ | C. | ①③④ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知元素X的基态原子最外层电子排布为nsn﹣1npn+2,则它最高价氧化物对应的水化物的酸根离子是( )
|
| A. | RO | B. | RO43﹣ | C. | RO | D. | RO32﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组热化学方程式程中,化学反应的△H前者大于后者的是( )
①CaCO3(s)=CaO(s)+CO2(g)△H1 CaO(s)+H2O(l)=Ca(OH)2(s)△H2
②C(s)+O2(g)=CO2(g)△H3C(s)+1/2O2(g)=CO(g)△H4
③S(s)+O2(g)=SO2(g)△H5S(g)+O2(g)=SO2(g)△H6.
|
| A. | ①③ | B. | ①② | C. | ②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知NaHSO4在水中的电离方程式为NaHSO4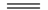 Na+ + H++
Na+ + H++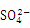 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。对于该溶液,下列叙述中不正确的是
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。对于该溶液,下列叙述中不正确的是
A.该温度高于25℃
B.水电离出来的c(H+)= 1×10-10 mol • L﹣1
C.c(H+)=c(OH-))+c(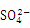 )
)
D.该温度下加入等体积pH为12的NaOH溶液可使反应后的溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量浓度相同时,下列既能跟NaOH溶液反应,又能跟盐酸反应的溶液中,pH最大的是( )
|
| A. | Na2CO3溶液 | B. | NH4HCO3溶液 | C. | NaHCO3溶液 | D. | NaHSO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com