
| ①中的反应物 | ②中的现象 | 实验结论 | 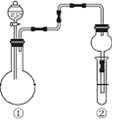 | |
| A | 纯碱、稀硫酸 | 硅酸钠溶液中出现白色沉淀 | 酸性:硫酸>碳酸>硅酸 | |
| B | MnO2、浓盐酸 | 淀粉KI溶液变蓝 | Cl2有氧化性 | |
| C | Na2SO3、硫酸 | 溴水褪色 | SO2有漂白性 | |
| D | Cu、硝酸 | 红棕色气体 | ①中硝酸为浓硝酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.发生强酸制取弱酸的反应;
B.MnO2与浓盐酸反应生成氯气,需要加热;
C.生成的二氧化硫与溴水发生氧化还原反应,生成硫酸和HBr;
D.Cu与稀硝酸反应生成NO,NO被空气氧化生成红棕色的气体.
解答 解:A.发生强酸制取弱酸的反应,由现象可知酸性:硫酸>碳酸>硅酸,故A正确;
B.MnO2与浓盐酸反应生成氯气,需要加热,则图中装置不能制备氯气,故B错误;
C.生成的二氧化硫与溴水发生氧化还原反应,生成硫酸和HBr,S元素的化合价升高,则二氧化硫具有还原性,故C错误;
D.Cu与稀硝酸反应生成NO,NO被空气氧化生成红棕色的气体,装置中含空气,则硝酸可能为稀硝酸或浓硝酸,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握酸性比较、物质的制备、发生的反应、实验技能为解答的关键,侧重分析与实验能力的考查,注意化学实验方案的评价,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 水库中的钢闸门通常连接锌块,是采用了牺牲阳极的阴极保护法 | |
| B. | 化学电源都是一次能源 | |
| C. | 铁的表面镀铜的过程中,铜极连接电源负极 | |
| D. | 合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其组成成分金属强 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
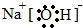 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
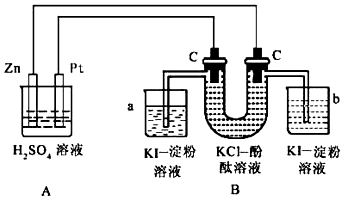
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素在自然界中都有游离态 | |
| B. | X分别与W、Y、Z都可组成具有漂白性的物质,且它们的漂白原理相同 | |
| C. | 元素W、Y的氯化物中,各原子(或离子)均满足8电子的稳定结构 | |
| D. | 元素W可与元素X形成一种既含极性键又含非极性键的共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,Co元素的化合价升高 | |
| B. | 放电时,正极的电极反应式为Lil-xCoO2+xe-+xLi+=LiCoO2 | |
| C. | 充电时,Li+在电解质中由阳极向阴极迁移 | |
| D. | 充电时,阴极的电极反应式为C6+xLi++xe-=LixC6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×l0-10 |
| CH3COOH | K=1.8×l0-5 |
| H2CO3 | K1=4.3×l0-7、K2=5.6×l0-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com