
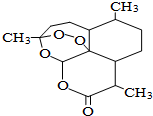
 青蒿素是一种高效、速效抗疟药,是中医药献给世界的一份礼物.屠呦呦因在发现、研究青蒿素方面做出的杰出贡献而获得2015年诺贝尔医学奖.青蒿素分子结构如图,下列说法中正确的是( )
青蒿素是一种高效、速效抗疟药,是中医药献给世界的一份礼物.屠呦呦因在发现、研究青蒿素方面做出的杰出贡献而获得2015年诺贝尔医学奖.青蒿素分子结构如图,下列说法中正确的是( )| A. | 青蒿素能与热的NaOH溶液反应 | B. | 青蒿素的分子式为C15H21O5 | ||
| C. | 青蒿素分子结构中只含有极性键 | D. | 青蒿素能使酸性KMnO4溶液褪色 |
科目:高中化学 来源: 题型:选择题
| A. | 该烃分子内既有碳碳双键又有碳碳三键 | |
| B. | 该烃分子内碳原子数超过6 | |
| C. | 该烃能发生氧化反应和加聚反应 | |
| D. | 化合物B有两种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
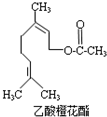 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是( )| A. | ①②③ | B. | ①②⑤ | C. | ②④⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
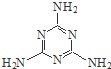 密胺是重要的工业原料,结构简式如图.工业上用液氨和二氧化碳为原料,硅胶为催化剂,在一定条件下,通过系列反应生成密胺.若原料完全反应生成密胺,则NH3和CO2的质量之比应为( )
密胺是重要的工业原料,结构简式如图.工业上用液氨和二氧化碳为原料,硅胶为催化剂,在一定条件下,通过系列反应生成密胺.若原料完全反应生成密胺,则NH3和CO2的质量之比应为( )| A. | 17:44 | B. | 22:17 | C. | 17:22 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH4(g)+H2O(g)△H=-203kJ•mol-1.
CH4(g)+H2O(g)△H=-203kJ•mol-1.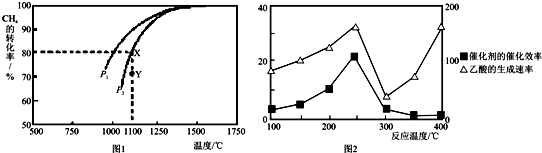
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将废电池深埋,可防止重金属污染 | |
| B. | 所有需要加热的化学反应都是吸热反应 | |
| C. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 | |
| D. | 开发利用可燃冰是缓解能源紧缺的唯一途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
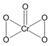 .
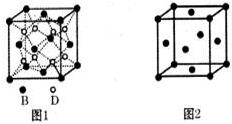
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com