
| A. | 金属发生腐蚀的实质是:M-ne-=Mn+ | |
| B. | 金属发生的电化学腐蚀比化学腐蚀要普遍得多 | |
| C. | 防止金属生锈可以通过涂油漆、镀金属等方法在其表面覆盖一层保护膜 | |
| D. | 在钢铁上连接一个铜块可以防止钢铁生锈 |
分析 金属腐蚀的本质为金属失去电子,以电化学腐蚀为主,可利用物理方法或电化学方法保护金属,以此来解答.
解答 解:A.金属发生腐蚀的实质是:M-ne-=Mn+,为失去电子被氧化的过程,故A正确;
B.金属发生的电化学腐蚀比化学腐蚀要普遍得多,一般在构成原电池,故B正确;
C.防止金属生锈可以通过涂油漆、镀金属等方法在其表面覆盖一层保护膜,可隔绝金属与空气,故C正确;
D.在钢铁上连接一个铜块,构成原电池时Fe 为负极,加快钢铁生锈,故D错误;
故选D.
点评 本题考查电化学腐蚀,为高频考点,把握金属腐蚀的实质及防护方法为解答的关键,侧重分析与应用能力的考查,注意牺牲阳极的阴极保护法的应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 在反应中不一定所有元素的化合价都发生变化 | |
| C. | 金属单质在反应中只作还原剂,非金属单质在反应中只作氧化剂 | |
| D. | 金属原子失电子越多,其还原性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1 | K1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ/mol | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ/mol | K3 |
| 化学键 | H-H | C≡O | C-O | H-O | C-H |
| E/(kJ/mol) | 436 | 1076 | 343 | 465 | 413 |
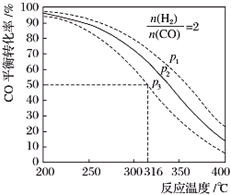
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:9:24:14:28 | B. | 1:2:5:3:6 | C. | 8:9:12:10:20 | D. | l:l:l:l:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9种、7种、6种 | B. | 9种、5种、6种 | C. | 7种、5种、4种 | D. | 8种、5种、5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池属于二次电池,在充电过程中,阳极质量减小,阴极质量增加 | |
| B. | 常温下,能自发进行的反应,△H一定小于“0” | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的活化能 | |
| D. | 相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com