
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
【答案】D
【解析】石墨电极为惰性电极,溶液中阳离子在阴极放电,阴离子在阳极放电。A、电解AgNO3溶液,Ag+在阴极放电生成Ag,OH-在阳极放电生成O2,且n(Ag)∶n(O2)=2∶1,则应加入Ag2O恢复浓度,故A错误;B、电解NaOH溶液,H+在阴极放电生成H2,OH-在阳极放电生成O2,且n(H2)∶n(O2)=2∶1,则应加入一定量的H2O恢复原样,故B错误;C、电解KCl溶液,H+在阴极放电生成H2,Cl-在阳极放电生成Cl2,且n(H2)∶n(Cl2)=1∶1,则应加入一定量HCl恢复原样,故C错误;D、电解CuSO4溶液,Cu2+在阴极放电生成Cu,OH-在阳极放电生成O2,且n(Cu)∶n(O2)=2∶1,则应加入一定量CuO恢复原样,故D正确。故选D。
点睛:分析电解反应的原理,在两极析出什么物质(固体或气体),相当于什么物质脱离反应体系,根据元素守恒和原子比例,加入对应的物质,即可使溶液完全复原。
【题型】单选题
【结束】
28
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
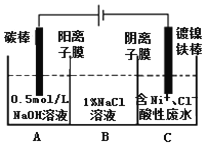
已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
【答案】B
【解析】A.由图知,碳棒与电源正极相连是电解池的阳极,电极反应4OH--4e-=2H2O+O2↑,故A正确;B.镀镍铁棒与电源负极相连是电解池的阴极,电极反应Ni2++2e-=Ni.电解过程中为平衡A、C中的电荷,A中的Na+和C中的Cl-分别通过阳离子膜和阴离子膜移向B中,这使B中NaCl溶液的物质的量浓度不断增大,故B错误;C.因Ni2+在弱酸性溶液中易发生水解;氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度),为了提高Ni的产率,电解过程中需要控制废水pH,故C正确;D.若将图中阳离子膜去掉,由于放电顺序Cl->OH-,则Cl-移向阳极放电:2Cl--2e-=Cl2↑,电解反应总方程式会发生改变,故D正确;故选B。


科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中,不能说明反应:C(s) +CO2(g)![]() 2CO(g)已达到平衡状态的是
2CO(g)已达到平衡状态的是
A. 每消耗1 mol CO2的同时生成2 mol CO
B. 混合气体的平均相对分子质量不再改变
C. 容器中气体的压强不再改变
D. 容器中气体的密度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将V1 L 0.1mol/L NaOH溶液与V2 L 0.6mol/L NaOH溶液混合,所得溶液浓度为0.3mol/L,如果混合后的体积为混合前的体积和,V1:V2=( )
A.1:2
B.2:1
C.3:2
D.2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每到冬天就会出现大雾天气,能见度不到10米,致使汽车行驶受阻,下列关于雾的说法正确的是( )
A.无法确定雾中水滴的直径大小
B.不会产生丁达尔现象
C.雾中水滴的直径在1nm~100nm间
D.雾中水滴的直径小于1nm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500mLKNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6.0mol/L.用石墨作电极电解此溶液,当通电一段时间后,两极都收集到22.4L气体(标准状况),假设电解后溶液的体积仍为500mL.下列说法正确的是( )
A. 原混合溶液中K+的物质的量浓度为1mol/L
B. 上述电解过程中共转移4mol电子
C. 加入CuO可使溶液恢复到原来的成分和浓度
D. 电解后溶液中H+的物质的量浓度为2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量均为amol的FeCl3和CuCl2投人水中形成混合溶液,再加入bmol铁粉充分反应(忽略离子的水解),下列说法中不正确的是
A. 当b≥![]() 时,发生总反应的离子方程式为2Fe3++Cu2++2Fe=4Fe2++Cu
时,发生总反应的离子方程式为2Fe3++Cu2++2Fe=4Fe2++Cu
B. 当![]() <b<
<b<![]() 时,反应中转移电子的物质的量:amol<n(e-)<3amol
时,反应中转移电子的物质的量:amol<n(e-)<3amol
C. 当b≤![]() 时,发生的离子反应为2Fe3++Fe=3Fe2+
时,发生的离子反应为2Fe3++Fe=3Fe2+
D. 当![]() <b<
<b<![]() 元时,反应后的溶液中n(Cu2+):n(Fe2+)=(
元时,反应后的溶液中n(Cu2+):n(Fe2+)=(![]() -b):(b+a)
-b):(b+a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分:
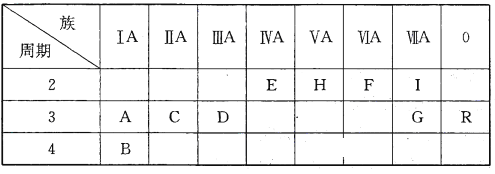
根据要求回答下列问题:
(1)十种元素中化学性质最不活泼的元素是__________________(填元素符号,下同),形成化合物种类最多的元素是_____________________。
(2)A、C、D三种元素的最高价氧化物对应的水化物,其中碱性最强的是______________(填化学式,下同),E、H、G三种元素的最高价氧化物对应的水化物中酸性最强的是______________。
(3)I元素跟A元素形成化合物的电子式是______________。高温灼烧该化合物时,火焰呈______________色。
(4)分别写出B、G两种单质和水反应的离子方程式_____________、________________。
(5)元素A和F能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以Na2SO3粉末和70%H2SO4为原料制取SO2, 且以SO2为原料制取物质和进行性质探究。回答下列问题:
(1)学生甲欲收集一瓶干燥的SO2,选择图中的装置,其连接顺序为_________ (按气流方向,用小写字母表示); SO2有毒,为防止中毒实验应在_________中进行。

(2)学生乙欲通过量气法测定在空气中久置的亚硫酸钠粉末的纯度,最好选择下列装置 中 的_________(填字母) 。

(3)学生丙欲以CuSO4·5H2O 和SO2 等为原料制备谢弗勒尔盐(Cu2SO3·CuSO3·2H2O)实验装置如右图所示。已知谢弗勒尔盐是一种深红色固体,不溶于水和乙醇,100℃时发生分解。

回答下列问题:
装置A中SO2的作用是___________________; 体 系 温度 控 制 在 60~80℃ 的目的是___________。装置B的作用是_________。
(4)学生丁欲利用右图装置探究SO2使品红溶液褪色的实质。实验中观察到Ⅰ中红色褪去;Ⅱ中无现象。据此推断能使品红水溶液褪色的粒子可能是_________。如果要比较这些粒子使品红溶液褪色的快慢,请设计实验方案,简述操作和需要观察的现象________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com