
| A.② | B.④ | C.②④ | D.①③ |
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源:不详 题型:填空题
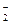 + xI-+ yH+ = 2NO↑+ I2 + zH2O,请回答下列问题:
+ xI-+ yH+ = 2NO↑+ I2 + zH2O,请回答下列问题: 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

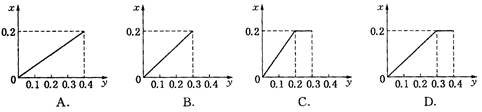
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硝酸使紫色石蕊试液先变红后褪色——酸性和强氧化性 |
| B.不能用稀硝酸与锌反应制氢气——强氧化性 |
| C.要用棕色瓶盛装浓硝酸——不稳定性 |
| D.能使滴有酚酞的氢氧化钠溶液红色褪去——强氧化性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (1)维生素C又称抗坏血酸,其水溶液显酸性。向维生素C的溶液中滴加紫色石蕊溶液,溶液变 色。
(1)维生素C又称抗坏血酸,其水溶液显酸性。向维生素C的溶液中滴加紫色石蕊溶液,溶液变 色。 某同学欲探究维生素C的还原性,可选择的试剂是 (填序号)。
某同学欲探究维生素C的还原性,可选择的试剂是 (填序号)。 ①氨水、淀粉
①氨水、淀粉  ② KI溶液 ③酸性KMnO4溶液
② KI溶液 ③酸性KMnO4溶液 (2)加碘盐可预防碘缺乏症,其中加入的含碘物质是碘酸钾。碘酸钾的化学式为 (填序号)。
(2)加碘盐可预防碘缺乏症,其中加入的含碘物质是碘酸钾。碘酸钾的化学式为 (填序号)。 ① I2
① I2  ② KI ③ KIO3
② KI ③ KIO3 已知在酸性条件下,碘化钾与碘酸钾反应可生成碘单质。若用盐酸酸化的碘化钾淀粉溶液检验加碘盐中的碘酸钾,可观察到的现象是 。
已知在酸性条件下,碘化钾与碘酸钾反应可生成碘单质。若用盐酸酸化的碘化钾淀粉溶液检验加碘盐中的碘酸钾,可观察到的现象是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 表示其原因 。
表示其原因 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a/b | B.a/2b | C.a/(a+2b) | D.a/2(a+b) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com