
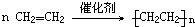 .
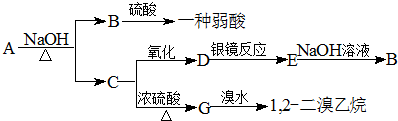
. 分析 具有水果香味的中性物质A能发生水解反应生成B、C,B和硫酸反应生成一种弱酸,则B是羧酸钠,C是醇,C被氧化生成D,D能发生银镜反应,则D为醛,D被氧化生成羧酸E,E和氢氧化钠反应生成羧酸钠B,则羧酸和醇分子中C原子相等,C发生消去反应生成G,G和溴发生加成反应生成1,2-二溴乙烷,则G结构简式为CH2=CH2、C结构简式为CH3CH2OH、D为CH3CHO、E为CH3COOH、B为CH3COONa、A为CH3COOCH2CH3,据此分析解答.
解答 解:具有水果香味的中性物质A能发生水解反应生成B、C,B和硫酸反应生成一种弱酸,则B是羧酸钠,C是醇,C被氧化生成D,D能发生银镜反应,则D为醛,D被氧化生成羧酸E,E和氢氧化钠反应生成羧酸钠B,则羧酸和醇分子中C原子相等,C发生消去反应生成G,G和溴发生加成反应生成1,2-二溴乙烷,则G结构简式为CH2=CH2、C结构简式为CH3CH2OH、D为CH3CHO、E为CH3COOH、B为CH3COONa、A为CH3COOCH2CH3,
(1)通过以上分析知,A、B、C和D分别是乙酸乙酯、乙酸钠、乙醇和乙醛,其结构简式分别为:CH3COOCH2CH3、CH3COONa、CH3CH2OH、CH3CHO,
故答案为:CH3COOCH2CH3、CH3COONa、CH3CH2OH、CH3CHO;
(2)A是乙酸乙酯,A和氢氧化钠的反应方程式为:CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH,在浓硫酸作催化剂、170℃条件下,乙醇发生消去反应生成乙烯,反应方程式为:CH3CH2OH$→_{浓H_{2}SO_{4}}^{170℃}$CH2=CH2+H2O,乙烯分子间发生加成聚合反应生成高分子化合物聚乙烯;反应的化学方程式为: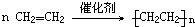 ,
,
故答案为:CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH,CH3CH2OH$→_{浓H_{2}SO_{4}}^{170℃}$CH2=CH2+H2O,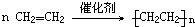 .
.
点评 本题考查了有机物的推断,明确有机物的官能团及其性质及物质间的转化是解本题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 酸与碱恰好完全反应生成正盐的溶液 | |
| B. | pH=7的溶液 | |
| C. | 使石蕊试液呈紫色的溶液 | |
| D. | c(H+)=c(OH-)=10-6mol•L-1的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③⑤ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
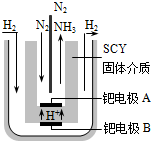 合成氨工业及硝酸工业对工、农生产和国防都有重要意义.请回答:
合成氨工业及硝酸工业对工、农生产和国防都有重要意义.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为198 | B. | 中子数为140 | C. | 质子数为82 | D. | 核外电子数为58 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
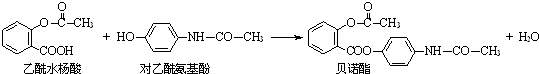
| A. | 贝诺酯分子中只有一种官能团 | |
| B. | 两种反应物均能与NaHCO3溶液反应放出CO2 | |
| C. | 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| D. | 贝诺酯与足量NaOH溶液共热,生成三种羧酸盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com