
 .
. 、
、 .
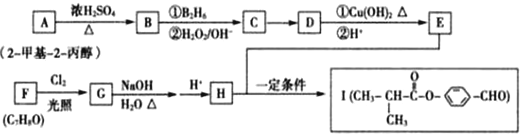
. 分析 A为2-甲基-2-丙醇,结构简式为(CH3)3COH,A在浓硫酸、加热条件下发生消去反应生成B为CH2=C(CH3)2,B发生已知信息中的反应生成C为(CH3)2CHCH2OH,在Cu或Ag、加热条件下发生催化氧化生成D为(CH3)2CHCHO,D再与氢氧化铜反应,发生氧化反应,再酸化得到E为(CH3)2CHCOOH,由I的结构可知,H为 ,逆推可知G为
,逆推可知G为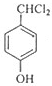 ,F为
,F为 ,
,
其合成路线以及相关反应为:
A→B:(CH3)3COH$→_{△}^{浓硫酸}$CH2=C(CH3)2+H2O
B→C:CH2=C(CH3)2$→_{②H_{2}O/OH-}^{①B_{2}H_{5}}$(CH3)2CHCH2OH
C→D:2(CH3)2CHCH2OH+O2$→_{△}^{Cu、O_{2}(或Ag、O_{2})}$2(CH3)2CHCHO+2H2O
D→E:
E+H→I: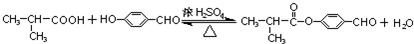
F→G: +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$ +2HCl
+2HCl
一个碳原子上连有两个羟基不稳定,易脱水形成羰基,所以
G→H: +H2O$→_{△}^{碱性}$
+H2O$→_{△}^{碱性}$ +2HCl,据此分析解答.
+2HCl,据此分析解答.
解答 解:(1)E为(CH3)2CHCOOH,由I的结构可知,E+H→I: ,H为
,H为 ,含有官能团有醛基、羟基,
,含有官能团有醛基、羟基,
故答案为:醛基、羟基;
(2)C为(CH3)2CHCH2OH,在Cu或Ag、加热条件下发生催化氧化生成D,C→D:2(CH3)2CHCH2OH+O2$→_{△}^{Cu、O_{2}(或Ag、O_{2})}$2(CH3)2CHCHO+2H2O,
D为醛,C为醇,检验权重是否含有醇:
a.Na能和醇反应生成氢气,而醛不能,所以能检验,故a正确;
b.NaOH溶液和醇醛都不反应,故b错误;
c.酸性高锰酸钾溶液具有强氧化性,醇、醛都能被氧化,不能检验,故c错误;
d.溴水具有强氧化性,醇、醛都能被氧化,不能检验,故d错误;
故答案为:Cu、O2、加热(或Ag、O2、加热);a;
(3)G为 ,与足量热的氢氧化钠溶液反应的化学方程式为
,与足量热的氢氧化钠溶液反应的化学方程式为 ,
,
故答案为: ;
;
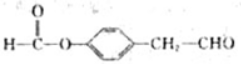
(4)I的同系物K相对分子质量比I小28,说明比I少2个-CH2-,同时满足如下条件:①苯环上只有两个对位取代基;②1molK与2molNaOH完全反应,说明含有酚酯的结构,
K的结构简式为: 、
、 ,
,
故答案为: 、
、 .
.
点评 本题考查有机物推断,需要对给予的信息进行利用,能较好的考查学生自学能力,熟练掌握官能团的性质与转化,再结合反应条件利用正推法推断,注意根据I、E分子式确定H的结构,(4)中同分异构体的书写是易错点,题目难点中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 LH2O中含有的原子总数为3NA | |
| B. | 等物质的量的Na2O和Na2O2中含有的阴离子总数不同 | |
| C. | Imol甲基(-14C1H3)所含的中子数和电子数分别为8NA、9NA | |
| D. | t℃时,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×l0-3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去苯中混有少量的苯酚可加人浓溴水后过滤 | |
| B. | 向酸性KMnO4溶液中滴加维生素C溶液,KMnO4溶液裉色,说明维生素C具有还原性 | |
| C. | 在淀粉溶液中加稀硫酸并加热后,加入适量银氨溶液,水浴加热后没有银镜生成,说明淀粉没有水解 | |
| D. | 将Na2SO3溶液蒸干,灼烧至恒重,最终剩余固体是Na2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示.下列说法正确的是( )
甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示.下列说法正确的是( )| A. | 若甲是Al,丙是Al(NO3)3,则乙一定是NaAlO2 | |
| B. | 若甲是Al2O3,丙是NaAlO2,则乙一定是Al(NO3)3 | |
| C. | 若甲是Al(NO3)3,丙是NaAlO2,则乙一定是Al(OH)3 | |
| D. | 若甲是Al(OH)3,丙是Al(NO3)3,则乙一定是NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
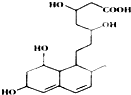
| A. | 含有两种官能团 | |
| B. | 能发生加成、酯化、氧化反应 | |
| C. | 1mol该物质与足量Na反应,产生2.5gH2 | |
| D. | 能使溴水和酸性高锰酸钾溶液褪色,褪色原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
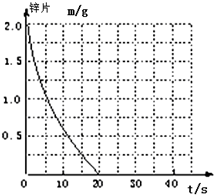 兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/L CuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K.
兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/L CuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K.| 实验编号 | 温度(K) | 盐酸浓度 | 醋酸浓度 | 实验目的 |
| ① | 298 | 0.20mol/L | / | a.实验①和②是探究不同温度对锌与盐酸反应速率的影响; b.实验①和③是探究不同浓度对锌与盐酸反应速率的影响; c.实验①和④是探究相同温度下,相同浓度的盐酸、醋酸与锌反应速率的区别. |
| ② | 308 | 0.20mol/L | / | |
| ③ | 298 | 0.40mol/L | / | |
| ④ | 298 | / | 0.20 |
| 实验步骤 | 预期现象 |
| ①将不连接的铜、锌电极插入稀硫酸中,②将铜、锌电极用导线连接放入稀硫酸中 | 产生氢气的速率②大于①,证明构成原电池后可以大大加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 厕所清洁剂pH=1 | B. | 食醋pH=3 | C. | 肥皂水pH=10 | D. | 厨房洗涤剂pH=12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
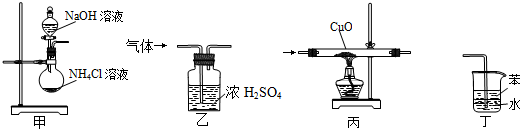
| A. | 用装置甲制取氨气 | B. | 用装置乙除去氨气中的水蒸气 | ||
| C. | 用装置丙验证氨气具有还原性 | D. | 用装置丁吸收氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中:K+、Fe3+、NO3-、Cl- | |
| B. | 酸性溶液中:HClO、K+、SO42-、I- | |
| C. | 强碱性溶液中:Ca2+、K+、HCO3-、NO3- | |
| D. | 碱性溶液中:Na+、SO32-、NO3-、S2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com