
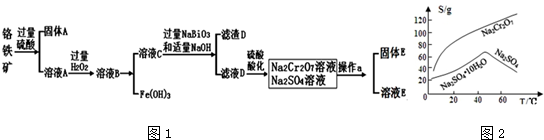
分析 铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质),加入过量稀硫酸,固体A为SiO2,溶液A中含有Cr3+、Al3+、Fe2+,在A中加入过氧化氢,可生成Fe3+,调节溶液pH可除去Fe3+、Al3+,生成氢氧化铁、氢氧化铝沉淀,溶液C含有Cr3+,在溶液C中加入NaBiO3和NaOH,发生氧化还原反应,固体D为Bi(OH)3,溶液D含有Na2CrO4,酸化可得Na2Cr2O7,溶液经蒸发浓缩、冷却结晶可得Na2Cr2O7•2H2O,
(1)三氧化二铬与铝在高温条件下发生置换反应生成铬与三氧化二铝;
(2)盐酸中的氯是-1价具有还原性,会CrO42-被氧化成氯气;
(3)由图2可知Na2Cr2O7的溶解度随温度的升高而增大,而硫酸钠的温度随温度的升高而降低,所以采用蒸发结晶、趁热过滤的方法分离硫酸钠;
(4)①Cr(OH)3的化学性质与Al(OH)3相似,如果氢氧化钠过量Cr(OH)3会溶解;
②可以代替上述流程中Na2S2O3溶液,需要具有还原性,能还原重铬酸根离子;
③每消耗0.1mol Na2S2O3转移0.8mol e-,Na2S2O3 ~2SO42-~8e-,Cr2O72-~2Cr3+~6e-,依据氧化还原反应电子守恒分析配平书写氧化还原反应的离子方程式.
解答 解:(1)三氧化二铬与铝发生铝热反应的方程式为:Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Cr+Al2O3;故答案为:Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Cr+Al2O3 ;
(2)盐酸中的氯是-1价具有还原性,会被CrO42-氧化成氯气,故答案为:Cr2O72-会氧化盐酸生成氯气,造成污染;
(3)由图2可知Na2Cr2O7的溶解度随温度的升高而增大,而硫酸钠的温度随温度的升高而降低,所以采用蒸发结晶、趁热过滤的方法分离硫酸钠,故答案为:蒸发结晶;趁热过滤;
(4)①Cr(OH)3的化学性质与Al(OH)3相似,如果氢氧化钠过量Cr(OH)3会溶解,发生离子方程式为Cr(OH)3+OH-=CrO2-+2H2O,
故答案为:Cr(OH)3+OH-=CrO2-+2H2O;
②可以代替上述流程中Na2S2O3溶液,需要具有还原性,能还原重铬酸根离子;
A.FeSO4溶液中亚铁离子具有还原性,可以还原Cr2O72-离子,但又引入新的杂质离子铁离子,故A不符合;
B.浓H2SO4 具有强氧化性,不能表现还原性,不能还原Cr2O72-,故B不符合;
C.酸性KMnO4 是强氧化剂不能还原Cr2O72-,故C不符合;
D.Na2SO3溶液中亚硫酸根离子具有还原性,可以还原Cr2O72-,故D符合;
故答案为:D;
③每消耗0.1mol Na2S2O3转移0.8mol e-,Na2S2O3 ~2SO42-~8e-,Cr2O72-~2Cr3+~6e-,依据氧化还原反应电子守恒配平书写,3Na2S2O3 ~6SO42-~24e-,4Cr2O72-~8Cr3+~24e-,得到的氧化还原反应的离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
点评 本题考查了物质分离提纯的方法和过程分析,离子方程式书写,溶度积常数的计算应用,主要是氧化还原反应的理解应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2通入正极区 | |
| B. | 总反应为:2H2+O2═2H2O | |
| C. | 正极发生氧化反应 | |
| D. | 负极区电极反应为 2H2+4OH--4e-═4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
如图为反应Fe + CuSO4 === FeSO4 + Cu中电子转移的关系图,则图中的元素甲、乙分别表示
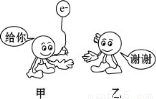
A.Fe Cu
B.Cu S
C.Fe O
D.Fe S
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
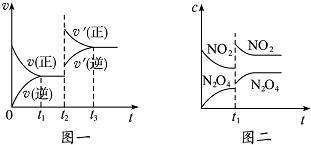
| A. | 图一t2时改变的条件可能是升高了温度或增大了压强 | |
| B. | 图一t2时改变的条件是增大压强,则反应的△H增大 | |
| C. | 图二t1时改变的条件可能是升高了温度 | |
| D. | 若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的离子积常数KW | B. | 可逆反应的平衡常数K | ||
| C. | 0.1mol/LCH3COONa溶液的pH | D. | NH3•H2O的电离常数Kb |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L H2中含有的H原子数是NA | |
| B. | 标准状况下,11.2L CCl4含有0.5NA个分子 | |
| C. | 0.1 mol C含质子数为1.2NA | |
| D. | 2.3g金属钠含有的电子数为1.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com