
����Ŀ��W��X��Y��Z��ԭ���������������ͬһ������Ԫ�أ�W��X�ǽ���Ԫ�أ�Y��Z�Ƿǽ���Ԫ�ء���ش��������⣺
��1��W��X���Ե�����������Ӧ��ˮ������Է�Ӧ�����κ�ˮ���÷�Ӧ�����ӷ���ʽΪ ��
��2��W��Y���γɻ�����W2Y���û�����ĵ���ʽΪ ��
��3��Y�����ڱ��е�λ���� ��
��4���Ƚ�W��X��Y��Z����Ԫ�ؼ����ӵİ뾶��С���û�ѧʽ��ʾ����ͬ���� �� �� �� ���Ƚ�Y��Z����̬�⻯���ȶ���ǿ���� �� ��
��5��Y�ĵͼ�������ͨ��Z���ʵ�ˮ��Һ�У�������Ӧ�Ļ�ѧ����ʽΪ�� ��
��6��Z�����������Ϊ��ɫҺ�壬0.25mol��������һ����ˮ��ϵõ�һ��ϡ��Һ�����ų�Q kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
���𰸡���1��Al��OH��3+OH��=AlO2��+2H2O��2��![]() ��3���������ڵ���A��
��3���������ڵ���A��
��4��S 2����Cl����Na+��Al3+��HCl��H2S ��5��SO2+Cl2+2H2O�TH2SO4+2HCl
��6��Cl2O7��l��+H2O��l����2HClO4��aq����H=��4QkJmol��1
�������������������1��W��X�ǽ���Ԫ�أ�W��X���Ե�����������Ӧ��ˮ������Է�Ӧ�����κ�ˮ��˵�����ɵ���һ����ƫ�����ƣ���W��Na��X��Al����Ӧ�����ӷ���ʽ��Al��OH��3+OH��=AlO2��+2H2O��
��2��Y��Z�Ƿǽ���Ԫ�أ�W��Y���γɻ�����W2Y������W��X��Y��Z��ԭ���������������ͬһ������Ԫ�ؿ�֪Y��S�������Ǻ������Ӽ������ӻ�������Ըû�����ĵ���ʽΪ![]() ��
��
��3�����ԭ��������16�������ڱ��е�λ���ǵ������ڵ���A�壻
��4��Z��ԭ��������Y�������Z����Ԫ�ء����ӵĵ��Ӳ���Խ�٣����Ӱ뾶ԽС�������������Ų���ͬ��������ԭ������Խ�����Ƚ�ԽС���������Ƚϴ�С˳����S2��>Cl��>Na+>Al3+���ǽ�����Խǿ���⻯����ȶ���Խǿ�����ȶ�����HCl��H2S��
��5�������ܰ�SO2����������������ᣬ����Y�ĵͼ�������ͨ��Z���ʵ�ˮ��Һ�У�������Ӧ�Ļ�ѧ����ʽΪSO2+Cl2+2H2O=H2SO4+2HCl��
��6��Z���������������ˮ�����ɸ����ᣬ��Ӧ�Ļ�ѧ����ʽ��Cl2O7+H2O��2HClO4������0.25 mol��������һ����ˮ��ϵõ�һ��ϡ��Һ�����ų�QkJ�����������Է�Ӧ���Ȼ�ѧ����ʽ��
Cl2O7��1��+H2O��1����2HClO4(aq) ��H=��4QkJ/mol��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л�������γ�˳���칹���ǣ� ��
A����ϩ
B��1���ȩ�1����ϩ
C��2������2����ϩ
D��2��3��������2����ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��3�����ʽṹ�����ʡ�
X��Y��Z��WΪǰ������Ԫ����ԭ��������������X�ĵ��Ӳ������ں����������YԪ�ػ�̬ԭ�Ӻ���δ�ɶԵ�����Ϊ2��X��Y�γɵĻ������ڳ�����Ϊ������Һ��R��ZԪ��ԭ��������Ӳ���s��p��������ȣ�W��̬ԭ��3d����ĵ�������4s�����������3������ش��������⣺
��1��Y��̬ԭ�ӵļ۵����Ų�ͼΪ �����һ��������ͬ����Ԫ�����ɴ�С�ŵ� λ��
��2��W��Ԫ������Ϊ �����̬ԭ�Ӻ����� �ֿռ��˶�״̬��ͬ�ĵ��ӡ�
��3��R������ԭ�Ӳ�ȡ���ӻ���ʽΪ ��д��R��һ���ȵ����壺 �����ѧʽ����
��4��Z��Y��һ�������¿��γɸ�Ӳ�ȵĻ�����û�����ľ�������Ϊ ������Z��Y���ɵ���С��Ϊ Ԫ����
��5��W�ĵ�����900������Ϊ������������������910������Wת��Ϊ�����������������������ṹ�ֱ���ͼ��ʾ�����־����о����������ԭ�Ӽ������ͬ������800����1000���£������ܶ�֮��Ϊ ��
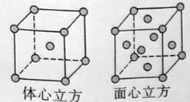
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1����������������Ӧ��
A��NaOH + HCl = NaCl + H2O
B��2FeCl3 + Cu = 2FeCl2 + CuCl2
����������Ӧ�����ж�, ����Ƴ�ԭ���(����A������B��)��
�����(A��B)������˵����ԭ�� ��
2���о������к������Ҫ��SO2��H2S����ת��������Ҫ���塣
��1����ʪ�����£�д��������SO2ת��ΪHSO3-�ķ���ʽ��_____________��
��2�������е�����ɽ�������H2S��������Ӧ������SO42-��������Ӧ�������仯ʾ��ͼ���£�
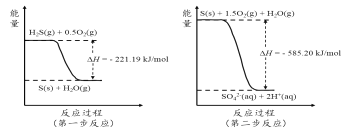
1mol H2S��g��ȫ��������SO42-��aq�����Ȼ�ѧ����ʽΪ______________________��
��3�������������������ӽ���Ĥȼ�ϵ�ؿ������ô�������SO2������������װ��ʾ��ͼ���£�

���ӵ���������Ϊ___________������A��B��������B��A������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У����������������������������������������ǣ�
A. OH- B. Mg2+ C. OD- D. D3O+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ���ܴ��������һ�����ӻ������
A��NH��H����NO��HCO
B��Na����CH3COO����CO��OH��
C��Na����K����SO��Cl2
D��K����Al3����SO��NH3��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���в�ҩ��Ƥ�к��е���Ҷ��������ÿ���۵��ʾһ��̼ԭ�ӣ���ԭ��δ�����������п������á���1 mol��Ҷ�������ֱ���Ũ��ˮ��NaOH��Һ��ȫ��Ӧ�������ĵ�Br2��NaOH�����ʵ����ֱ�Ϊ�� ��
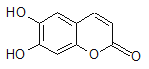
A��2 mol Br2 2 mol NaOH
B��2 mol Br2 3 mol NaOH
C��3 mol Br2 4 mol NaOH
D��4 mol Br2 4 mol NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������Ļ�����A������Է�������Ϊ104��̼����������Ϊ92.3%��
��1��A�ķ���ʽΪ________________________��
��2��A��������Ȼ�̼��Һ��Ӧ�Ļ�ѧ����ʽΪ____________________________��
��3����֪��![]()
![]()
![]() �� ��д��A��ϡ�����KMnO4��Һ
�� ��д��A��ϡ�����KMnO4��Һ
�ڼ��������·�Ӧ������Ľṹ��ʽ__________________________________��
��4����һ�������£�A��������Ӧ���õ��Ļ�������̼����������Ϊ85.7%��д���˻�����Ľṹ��ʽ______________________________��
��5����һ�������£���A�ۺϵõ��ĸ߷��ӻ�����Ľṹ��ʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в����γ���λ�����ǣ� ��
A��Ag+ NH3 B��Cu2+ NH3 C��H+ H2O D��Ag+ CH4
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com