
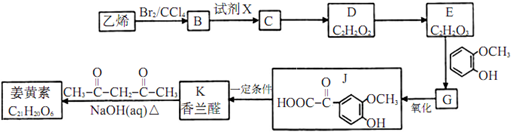

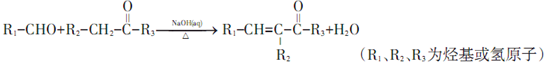
 ;
;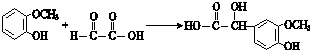 ;其反应类型是加成反应;
;其反应类型是加成反应;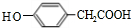 (写结构简式).
(写结构简式). 分析 乙烯和溴发生加成反应生成B为BrCH2CH2Br,由B→E转化及D、E分子式可知,E中含有羧基,D氧化得到E,则D中含有-CHO,则B在氢氧化钠水溶液、加热条件下发生水解反应生成C为HOCH2CH2OH,D为OHC-CHO,D中部分醛基被氧化生成E为OHC-COOH,结合J的结构可知,E中醛基发生加成生成G为 ,G中的醛基被氧化生成J,J在一定条件下发生信息i中脱羧反应生成K为
,G中的醛基被氧化生成J,J在一定条件下发生信息i中脱羧反应生成K为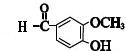 ,结合信息ii及姜黄素的分子式,可知姜黄素的结构简式为:
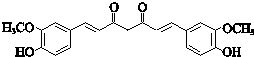
,结合信息ii及姜黄素的分子式,可知姜黄素的结构简式为: ,据此解答.
,据此解答.
解答 解:乙烯和溴发生加成反应生成B为BrCH2CH2Br,由B→E转化及D、E分子式可知,E中含有羧基,D氧化得到E,则D中含有-CHO,则B在氢氧化钠水溶液、加热条件下发生水解反应生成C为HOCH2CH2OH,D为OHC-CHO,D中部分醛基被氧化生成E为OHC-COOH,结合J的结构可知,E中醛基发生加成生成G为 ,G中的醛基被氧化生成J,J在一定条件下发生信息i中脱羧反应生成K为
,G中的醛基被氧化生成J,J在一定条件下发生信息i中脱羧反应生成K为 ,结合信息ii及姜黄素的分子式,可知姜黄素的结构简式为:
,结合信息ii及姜黄素的分子式,可知姜黄素的结构简式为: .
.
(1)E为OHC-COOH,所以E中含羧基和醛基,故答案为:羧基、醛基;
(2)B是乙烯与溴加成的产物,名称为1,2-二溴乙烷;B发生卤代烃的水解反应,试剂X是氢氧化钠的水溶液,故答案为:1,2-二溴乙烷;NaOH水溶液;
(3)K在氢氧化钠溶液中发生类似已知ii的反应生成姜黄素,所以姜黄素的结构简式为 ,
,
故答案为: ;
;
(4)E与邻羟基苯甲醚发生加成反应生成G,E→G反应的化学方程式为: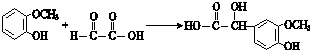 ,
,
故答案为: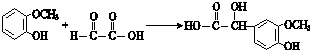 ;加成反应;
;加成反应;
(5)香兰醛( )中含有醛基、酚羟基、苯环、醚键,不能与NaHCO3溶液反应,可以与浓溴水发生取代反应,与FeCl3溶液发生显色反应,1 mol香兰醛最多能与4molH2发生加成反应,故ad错误,bc正确,故答案为:bc;
)中含有醛基、酚羟基、苯环、醚键,不能与NaHCO3溶液反应,可以与浓溴水发生取代反应,与FeCl3溶液发生显色反应,1 mol香兰醛最多能与4molH2发生加成反应,故ad错误,bc正确,故答案为:bc;
(6)K( )的同分异构体中符合下列信息:①含有苯环;②苯环上只有两个支链;③遇FeCl3溶液变色,说明含有酚羟基;④能与NaHCO3溶液反应,含有羧基,故两个侧链为-OH、-CH2COOH,有邻、间、对三种,其中核磁共振氢谱中有五种不同化学环境的氢原子的是:
)的同分异构体中符合下列信息:①含有苯环;②苯环上只有两个支链;③遇FeCl3溶液变色,说明含有酚羟基;④能与NaHCO3溶液反应,含有羧基,故两个侧链为-OH、-CH2COOH,有邻、间、对三种,其中核磁共振氢谱中有五种不同化学环境的氢原子的是: ,
,
故答案为:3; .
.
点评 本题考查有机物的推断与合成,需要学生对给予的信息进行利用,综合分析确定E的结构是关键,较好地考查学生自学能力与分析推理能力,注意掌握官能团想性质与转化,难度中等.


科目:高中化学 来源: 题型:选择题
| 序号 | 实验操作 | 实验目的 |
| ① | 将足量的SO2气体通入装有品红溶液的试管中 | 研究SO2具有漂白性 |
| ② | 向盛有10molAgNO3溶液的试管中滴加几滴NaCl溶液,再向其中滴加几滴Na2S | 比较Ksp(AgCl)与Ksp(Ag2S)的大小 |
| ③ | 测定等物质的量浓度HCl,HNO3的pH | 比较Cl,N的非金属性强弱 |
| ④ | 向2支试管中加入同体积通浓度的H2C2O4溶液,再分别加入同体积不同浓度的酸性KMnO4 | 研究浓度对反应速率的影响 |
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用装置A完成SiCl4的制备 | |
| B. | 用装置B进行蒸馏提纯SiCl4 | |
| C. | 用装置C进行滴定达终点时现象是:锥形瓶内溶液变为紫红色且半分钟内不变色 | |
| D. | 配制0.1 mol•L-1KMnO4溶液定容摇匀后,发现液面低于刻度线,加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,0.2 mol SO2和0.1 mol O2充分反应,生成SO3的分子数为0.2 NA | |
| B. | 1 L 0.1 mol/L的Na2CO3溶液中阴离子的个数是0.1 NA | |
| C. | 常温常压下,2.24 L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1 NA | |
| D. | 常温常压下,2 g D2O含有的质子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜是应用较为广泛的有色金属.
铜是应用较为广泛的有色金属.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
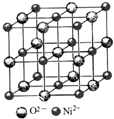 高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药.
高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,SO2、Cl- K+、HCO3-可以大量共存 | |
| B. | 和FeCl3溶液反应的离子方程式:S2-+Fe3+═Fe2++S | |
| C. | 和少量盐酸反应的离子方程式:S2-+H+═HS- | |
| D. | 1L0.1mol•L-1该溶液和足量硫酸铜溶液反应生成16.0克Cu2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com