
 在2L恒容密闭容器中,发生反应 2NO(g)+O2(g)?2NO2(g).
在2L恒容密闭容器中,发生反应 2NO(g)+O2(g)?2NO2(g).| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.007 | 0.006 | 0.006 | 0.006 |
分析 (1)根据v=$\frac{△c}{△t}$计算0~4s内v(NO),再利用速率之比等于化学计量数之比计算0~4s内v(O2),根据v=$\frac{△c}{△t}$计算1~5s内v(NO),然后进行比较判断;
(2)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比;可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(3)已知:K300℃>K350℃,说明升高温度平衡常数减小,平衡逆向移动,增大反应物浓度、使用催化剂均可以加快反应速率,增大反应物浓度,平衡正向移动,但使用催化剂不影响平衡移动,分离出生成物,使平衡正向移动,但反应速率会减慢;
(4)假设转化的氧气为xmol,则:
2NO(g)+O2(g)?2NO2(g)
起始量(mol):a b 0
转化量(mol):2x x 2x
平衡量(mol):a-2x b-x 2x
则(a-2x+b-x):2x=1:2,即a+b=4x,结合x<b及2x<a进行解答.
解答 解:(1)0~4s内v(NO)=$\frac{(0.020-0.006)mol}{\frac{2L}{4s}}$=0.00175mol/(L.s),速率之比等于化学计量数之比,则0~4s内v(O2)=$\frac{1}{2}$v(NO)=0.000875mol/(L.s),1~5s内v(NO)=$\frac{\frac{(0.010-0.006)mol}{2L}}{4s}$=0.0005mol/(L.s),故0~4s内以O2浓度变化表示的正反应速率大于1~5s内以NO浓度变化表示的正反应速率,
故答案为:大于;
(2)2NO(g)+O2(g)?2NO2(g)的平衡常数表达式K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)×c({O}_{2})}$;A.气体颜色不再变化,说明二氧化氮的浓度不变,反应到达平衡,故A正确; B.混合气体的质量始终不变,气体的总物质的量不确定,当气体平均相对分子质量保持不变,说明随反应进行容器内混合气体物质的量不变,此时为平衡状态,故B正确;C.由于υ逆(NO)=2υ逆(O2),而υ逆(NO)=2υ正(O2),则υ逆(O2)=υ正(O2),反应到达平衡,故C正确;D.混合气体总质量不变,容器容积不变,容器内密度始终保持不变,故D错误,故选:ABC;
故答案为:$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)×c({O}_{2})}$;ABC;
(3)A.适当升高温度,反应速率加快,由K300℃>K350℃,说明升高温度平衡常数减小,平衡逆向移动,故A错误;
B.充入Ar使压强增大,但不改反应物和生成物的浓度,反应速率不变,平衡不移动,故B错误;
C.增大O2的浓度,反应速率加快,平衡正向移动,故C正确;
D.选择高效催化剂,加快反应速率,但不影响平衡移动,故D错误,
故答案为:C;
(4)假设转化的氧气为xmol,则:
2NO(g)+O2(g)?2NO2(g)
起始量(mol):a b 0
转化量(mol):2x x 2x
平衡量(mol):a-2x b-x 2x
则(a-2x+b-x):2x=1:2,即a+b=4x,由于x<b,联立可得$\frac{a}{b}$<3,又由于2x<a,联立可得$\frac{a}{b}$>1,则1<$\frac{a}{b}$<3,
故答案为:1<$\frac{a}{b}$<3.
点评 本题考查化学平衡计算与影响因素、反应速率计算、平衡状态判断等,(4)中注意充分利用可逆反应不能完全反应进行分析解答,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
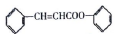 是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示:
是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示: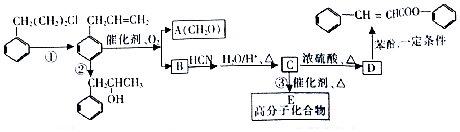
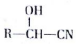 $→_{△}^{H_{2}O/H+}$
$→_{△}^{H_{2}O/H+}$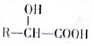
 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +nH2O.
+nH2O. (任写一种).
(任写一种).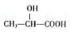 )的路线(其他试剂任选,合成路线常用的表示方式为A$\stackrel{反应试剂}{→}$B…$\stackrel{反应试剂}{→}$目标产物)
)的路线(其他试剂任选,合成路线常用的表示方式为A$\stackrel{反应试剂}{→}$B…$\stackrel{反应试剂}{→}$目标产物)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaO2的水解产物是Ba(OH)2和H2O2 | B. | PCl3水解的产物是HClO和PH3 | ||
| C. | CaC2水解的产物是Ca(OH)2和C2H2 | D. | Al2S3水解的产物是Al(OH)3和H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ②③⑦ | C. | ②③⑧ | D. | ②③⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
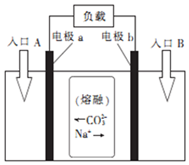 “直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能.用熔融Na2CO3作电解质的直接煤燃料电池的工作原理如图.下列有关说法正确的是( )
“直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能.用熔融Na2CO3作电解质的直接煤燃料电池的工作原理如图.下列有关说法正确的是( )| A. | 该电池的总反应为C+O2═CO2 | |
| B. | 煤直接燃烧发电比直接煤燃料电池发电的能量利用率高 | |
| C. | 进入反应室的煤块粉碎成粉末状对反应速率和限度均无影响 | |
| D. | 电子由电极b沿导线流向电极a,入口A加入的物质为煤粉 |
查看答案和解析>>
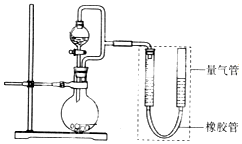
科目:高中化学 来源: 题型:实验题
 某校化学兴趣小组的同学在完成课本乙醇制乙醛的实验后,改进了实验方案(如图)按下列顺序进行如下实验操作.
某校化学兴趣小组的同学在完成课本乙醇制乙醛的实验后,改进了实验方案(如图)按下列顺序进行如下实验操作.| 实验变量 实验序号 | 银氨溶液的S/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH值 | 出现银镜的时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com