
【题目】某化学实验小组设计了如图装置证明和比较SO2和氯水的漂白性,其中B、D中为品红溶液,C中为NaOH溶液. 
(1)该化学兴趣小组同学为制取Cl2和SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2 , 采用MnO2和浓盐酸(12mol/L)为原料制取Cl2 . 请写出制取Cl2的离子方程式:
(2)反应开始后,发现B、D两个装置中的品红溶液都褪色,停止通气后,取B、D溶液于试管中分别加热,两个试管中的现象分别为:BD . 解释B中对应现象的原因 .
(3)装置C的作用是
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验: 
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅.试根据该实验装置和两名同学的实验结果回答问题.
①两同学在气体进入品红溶液之前,先将气体通过F装置,F中可盛装浓硫酸.其目的是使SO2和Cl2混合均匀并且 .
②试分析甲同学实验过程中,品红溶液不褪色的原因是: . (用离子方程式说明)
③你认为乙同学是怎样做到让品红溶液变得越来越浅的? .
【答案】
(1)MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)溶液恢复红色;溶液仍无色;二氧化硫与品红生成不稳定的无色物质,加热时无色物质分解又生红色的品红
(3)吸收多余的SO2和Cl2 , 防止污染环境
(4)通过观察气泡控制气体的流速;SO2+Cl2+2H2O=4H++SO42﹣+2Cl﹣;控制两种气体通入的量,使其物质的量不相等(或使其比例不等于1:1)
【解析】解:(1)采用MnO2和浓盐酸(12mol/L)为原料制取Cl2 . 制取Cl2的离子方程式为:MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O, 所以答案是:MnO2+4H++2Cl﹣
Mn2++Cl2↑+2H2O, 所以答案是:MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O;(2)SO2使品红褪色,生成不稳定的无色物质,可以看作是一个化合反应,该生成的无色物质不很稳定,受热又能分解放出SO2 , 而恢复原来的红色,氯气使品红褪色是氧化性漂白,不可还原,无法恢复,
Mn2++Cl2↑+2H2O;(2)SO2使品红褪色,生成不稳定的无色物质,可以看作是一个化合反应,该生成的无色物质不很稳定,受热又能分解放出SO2 , 而恢复原来的红色,氯气使品红褪色是氧化性漂白,不可还原,无法恢复,
所以答案是:溶液恢复红色;溶液仍无色;二氧化硫与品红生成不稳定的无色物质,加热时无色物质分解又生红色的品红;(3)氯气和二氧化硫都有毒,不能直接排放到空气中,所以用氢氧化钠吸收过量的二氧化硫和氯气,防止污染空气,
所以答案是:吸收多余的SO2和Cl2 , 防止污染环境;(4)①F中可盛装浓硫酸,其目的是使SO2和Cl2混合均匀并且通过观察气泡控制气体的流速;
所以答案是:通过观察气泡控制气体的流速;②氯气和二氧化硫在水溶液中恰好完全反应,反应的离子方程式为:SO2+Cl2+2H2O=4H++SO42﹣+2Cl﹣ , 生成的硫酸和盐酸不具有漂白性,所以品红溶液不褪色,
所以答案是:SO2+Cl2+2H2O=4H++SO42﹣+2Cl﹣;③当通入的二氧化硫或者氯气中一种气体过量,过量的氯气或者二氧化硫气体能够使品红褪色,
所以答案是:控制两种气体通入的量,使其物质的量不相等(或使其比例不等于1:1).
【考点精析】掌握氯气的化学性质是解答本题的根本,需要知道氯气的化学性质:与金属反应将金属氧化成高价态;非金属反应;与水反应;与碱反应;与还原性物质反应.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】2Zn(OH)2ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2ZnCO3的工艺流程如图: 
请回答下列问题:
(1)当(NH4)2SO4 , NH3H2O的混合溶液中存在c(NH4+)=2c(SO42﹣)时,溶液呈(填“酸”、“碱”或“中”)性.
(2)“浸取”时为了提高锌的浸出率,可采取的措施是(任写一种).
(3)“浸取”时加入的NH3H2O过量,生成MnO2的离子方程式为 .
(4)适量S2﹣能将Cu2+等离子转化为硫化物沉淀而除去,若选择ZnS进行除杂,是否可行?用计算说明原因: . [已知:Ksp(ZnS)=1.6×10﹣24 , Ksp(CuS)=1.3×10﹣36]
(5)“沉锌”的离子方程式为 .
(6)“过滤3”所得滤液可循环使用,其主要成分的化学式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知①N2+3H2 ![]() 2NH3;②3Cl2+8NH3=N2+6NH4Cl,判断下列物质的还原性从强到弱的顺序是( )
2NH3;②3Cl2+8NH3=N2+6NH4Cl,判断下列物质的还原性从强到弱的顺序是( )
A.NH4Cl>NH3>H2
B.H2>NH3>NH4Cl
C.NH3>NH4Cl>H2
D.H2>NH4Cl>NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下S2Cl2是橙黄色液体,其分子结构如图所示.少量泄漏会产生窒息性气味,遇水易水解,并产生酸性悬浊液.下列关于S2Cl2的说法错误的是( ) 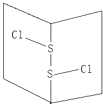
A.为非极性分子
B.分子中既含有极性键又含有非极性键
C.与S2Br2结构相似,熔沸点S2Br2>S2Cl2
D.与水反应的化学方程式可能为2S2Cl2+2H2O→SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法正确的是( ) 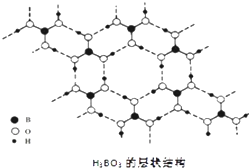
A.正硼酸晶体属于原子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8e﹣稳定结构
D.含1mol H3BO3的晶体中有3mol氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结晶玫瑰是具有强烈玫瑰气味的香料,可由下列反应路线合成(部分反应条件略去): 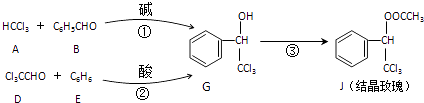
(1)A的类别是 , 能与Cl2反应生成A的烷烃是 . D中的官能团名称是 .
(2)反应③的化学方程式为
(3)已知:B ![]() 苯甲醇+苯甲酸钾,则经反应路线①得到的产物加水萃取、分液,能除去的副产物是
苯甲醇+苯甲酸钾,则经反应路线①得到的产物加水萃取、分液,能除去的副产物是
(4)B的核磁共振氢谱有4组峰,各组吸收峰的面积之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含分子数相同的是( )
A.10 g H2和10 g O2
B.5.6 L N2(标准状况)和22 g CO2
C.9 g H2O和0.5 mol Br2
D.224 mL H2和0.01 mol N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com