
FeS 与一定浓度的HNO3 反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO 和H2O,当NO2、N2O4、NO 的物质的量之比为1:1:1 时,实际参加反应的FeS 与HNO3的物质的量之比为()
A. 1:6 B. 1:7 C. 2:11 D. 16:25
考点: 氧化还原反应的计算.
专题: 氧化还原反应专题.
分析: 先根据转移电子守恒计算参加反应的n(FeS),根据硫原子的物质的量计算生成硫酸铁需要铁元素的物质的量,再根据剩余铁元素的物质的量计算起酸作用的硝酸的物质的量,根据气体的物质的量结合原子守恒计算被还原的硝酸的物质的量,从而得出FeS 与HNO3的物质的量之比.
解答: 解:设NO2、N2O4、NO 的物质的量都是1mol,生成物质的量分别都是1molNO2、N2O4、NO时,硝酸得到电子的物质的量=1mol×(5﹣4)+1mol×2×(5﹣4)+1mol×(5﹣2)=6mol,根据氧化还原反应中得失电子守恒计算n(FeS),
n(FeS)=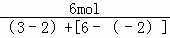 =
=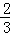 mol,
mol,
根据Fe2(SO4)3中硫酸根离子和铁离子的关系式知,生成硫酸铁需要的铁元素的物质的量=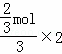 =
=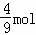 ,则剩余的
,则剩余的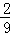 mol铁元素生成硝酸铁,
mol铁元素生成硝酸铁,
根据氮原子守恒知,生成Fe(NO3)3的硝酸的物质的量=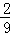 mol×3=
mol×3=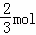 mol,
mol,
根据氮元素守恒得,生成物质的量分别都是1molNO2、N2O4、NO时消耗硝酸的物质的量=1mol+2mol+1mol=4mol,
所以实际参加反应的FeS 与HNO3的物质的量之比=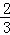 mol:(
mol:(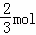 +4mol)=1:7,
+4mol)=1:7,
故选B.
点评: 本题考查了氧化还原反应的计算,根据转移电子守恒计算n(FeS),再结合原子守恒来分析解答,难度中等,也可以根据转移电子守恒配平方程式进行解答.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
关于活化分子说法错误的是()
A. 发生有效碰撞的分子一定是活化分子
B. 活化分子间的碰撞一定是有效碰撞
C. 能发生有效碰撞的分子必须具有相当高的能量
D. 使用催化剂能改变分子的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D、E、F、G、H、M九种物质,其中A、B、C均为氧化物,且A为淡黄色粉末,G、E为气体单质,F的水溶液与石灰水混合可制得D的溶液。它们之间相互转化关系如图所示,其他与题目无关的生成物均已略去。
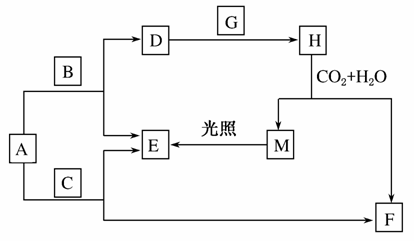
请回答下列问题:
(1)写出化学式:H________,C________。
(2)写出下列反应的化学方程式:
A+C→F+E________________________________________;
F+Ca(OH)2→D_____________________________________。
(3)写出离子反应方程式:D+G→H____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂.下列对于过氧化钙(CaO2)的叙述错误的是()
A. CaO2具有氧化性,对面粉可能具有增白作用
B. CaO2中阴阳离子的个数比为1:1
C. CaO2和水反应时,每产生1mol O2转移电子4mol
D. CaO2和CO2反应的化学方程式为:2CaO2+2CO2=2CaCO3+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为4种常见溶液中溶质的质量分数和物质的量浓度:
溶 质 HCl NaOH CH3COOH HNO3
溶质的质量分数/% 36.5 40 60 63
物质的量浓度/mol•L﹣1 11.8 14.3 10.6 13.8
这4种溶液中密度最小的是()
A. HCl B. NaOH C. CH3COOH D. HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
化学用语是化学学科的特色语言,化学用语可以准确表述化学现象、变化以及本质.完成下列有关方程式.
(1)硫代硫酸钠Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42﹣,常用作脱氯剂,该反应的离子方程式为;
(2)将某黄铜矿(主要成分为CuFeS2)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为.
(3)化学反应多姿多彩,把SO2通入硝酸铁溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时向溶液中滴加氯化钡溶液,有白色沉淀产生.请写出上述变化中溶液由棕黄色变为浅绿色,但立即又变为棕黄色所涉及的两个离子方程式:.
(4)焦亚硫酸钠(Na2S2O5)常用作食品漂白剂.已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为:.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com