
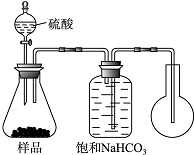
 碳酸氢钠是一种在生产、生活实际中有着重要用途的化合物.某课外兴趣活动小组的同学进行了以下的实验活动.
碳酸氢钠是一种在生产、生活实际中有着重要用途的化合物.某课外兴趣活动小组的同学进行了以下的实验活动.| 温度/℃ | 10 | 20 | 30 | 加热煮沸后,冷却至50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
| A、Cu2++2OH-=Cu(OH)2 CuCO3+2NaOH=Cu(OH)2+Na2CO3 |
| B、CO32-+2H+=CO2+H2O BaCO3+2HCl=BaCl2+CO2+H2O |
| C、Ca2++CO32-=CaCO3 Ca(NO3)2+Na2CO3=CaCO3+NaNO3 |
| D、H++OH-=H2O 2KOH+H2SO4=K2SO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 脑白金的主要作用是改善睡眠和润肠通便,主要成分是褪黑素(Melatonin)和低聚糖,其有效成分的结构简式如图,下列对该化合物的叙述正确的是( )
脑白金的主要作用是改善睡眠和润肠通便,主要成分是褪黑素(Melatonin)和低聚糖,其有效成分的结构简式如图,下列对该化合物的叙述正确的是( )| A、②③ | B、③ | C、③④ | D、①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com