
| A. | 若反应过程中消耗1mol氯气,则1mol<转移电子数<$\frac{5}{3}$mol | |
| B. | 反应停止后n(NaClO):n(NaCl):n(NaClO3)(物质的量之比)可能为1:11:2 | |
| C. | 反应过程中消耗氯气与NaOH的物质的量之比为1:2 | |
| D. | 氧化产物为NaClO和NaClO3,反应过程中n(NaClO):(NaClO3)为1:1 |
分析 发生反应有:Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O,
A.根据极值法及电子守恒计算出转移电子的范围;
B.根据氧化还原反应中得失电子相等判断;
C.根据钠离子和氯原子质量守恒分析参加反应的氢氧化钠和氯气的物质的量之比;
D.题中缺少次氯酸钠、氯酸钠的量,无法计算二者的物质的量之比.
解答 解:A.若amol氯气参与反应,发生反应有:Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O,若氧化产物只有NaClO,转移电子数最少,为amol×2×$\frac{1}{2}$×1=amol;氧化产物只有NaClO3,转移电子数最多,为amol×2×$\frac{5}{6}$×1=$\frac{5a}{3}$mol,所以反应转移电子为:amol<转移电子数<$\frac{5a}{3}$mol,故A正确;
B.设n(NaCl)=11mol、n(NaClO)=1mol、n(NaClO3)=2mol,生成NaCl获得的电子为:11mol×1=11mol,生成NaClO、NaClO3失去的电子为1mol×1+2mol×5=11mol,得失电子相等,故反应体系中n(NaClO):n(NaCl):n(NaClO3)(物质的量之比)可能为1:11:2,故B正确;
C.根据NaCl、NaClO、NaClO3可知,钠离子和氯原子的物质的量之比为1:1,则参加反应所需氯气与NaOH的物质的量之比为1:2,故C正确;
D.根据化合价变化可知,反应中NaC1O和NaClO3为氧化产物,但由于缺少数据,无法计算二者的物质的量之比,故D错误;
故选D.
点评 本题考查了氧化还原反应的有关计算,为高频考点,题目难度中等,根据原子守恒及转移电子守恒是解本题关键,并结合极限法分析解答,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
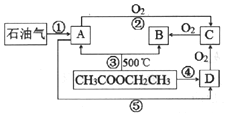 已知同温同压下烃A的密度与N2相同,C可发生银镜反应.它们之间的转化关系如图(部分反应条件和产物略去).请回答:
已知同温同压下烃A的密度与N2相同,C可发生银镜反应.它们之间的转化关系如图(部分反应条件和产物略去).请回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做衣服用的棉和麻均与淀粉互为同分异构体 | |
| B. | 煤经过气化和液化等化学变化可转化为清洁燃料 | |
| C. | 双氧水和75%的酒精均可用于杀菌消毒,但原理不同 | |
| D. | 局部麻醉剂氯乙烷、食用植物油、鸡蛋清均可发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用焰色反应即可鉴别NaCl、KCl和Na2SO4三种物质 | |
| B. | 向某溶液中加入淀粉溶液变蓝色,说明原溶液中含I2 | |
| C. | 向蛋白质溶液中加入Na2SO4浓溶液,可使蛋白质因溶解度降低而析出 | |
| D. | 用含NaOH的Cu(OH)2悬浊液检验病人尿样中葡萄糖的含量是否偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl溶于水能电离出H+、Cl-,所以HCl是离子化合物 | |
| B. | 碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力 | |
| C. | He、CO2和CH4都是由分于构成,它们中都存在共价键 | |
| D. | NaHCO3受热分解生成Na2CO3、CO2和H2O,旣破坏了离子键,也破坏了共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
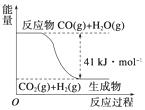
| A. | 任何化学反应都伴随能量的变化 | |
| B. | 化学反应中的能量变化主要是由化学键的变化引起的 | |
| C. | 化学反应中能量的变化都表现为热量的变化 | |
| D. | 由图示可知CO+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO2+H2的反应为放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com