
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:解答题
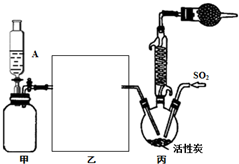 硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:
硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶常用作袋装食品的干燥剂,也可用作催化剂的载体 | |
| B. | 过渡元素金属作半导体材料 | |
| C. | 考古时利用14C测定一些文物的年代 | |
| D. | 纯净的SiO2是现代光学及光纤制品的基本原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LO2中一定含有NA个氧原子 | |
| B. | 将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol/L | |
| C. | 标准状况下,NA个H2O分子的体积是22.4L | |
| D. | 3.4gNH3含有的分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
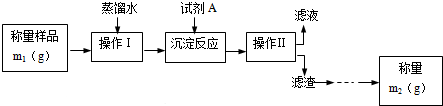
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 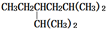 的系统命名法为2,5-二甲基-4-乙基己烷 的系统命名法为2,5-二甲基-4-乙基己烷 | |
| B. | 石油的裂化、煤的气化与液化都属于化学变化,而石油的分馏与煤的干馏都属于物理变化 | |
| C. | 总质量一定时,乙酸和葡萄糖无论以何种比例混合,完全燃烧消耗氧气的量相等 | |
| D. | 油脂、淀粉、蛋白质等高分子化合物都属于混合物,一定条件下均可发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
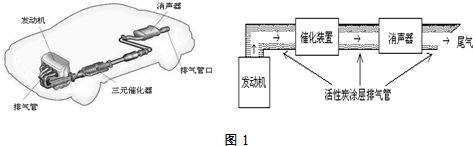
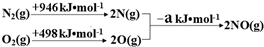
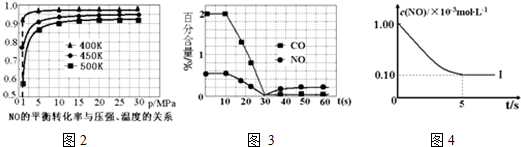
| 实验编号 | T(K) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表面积(m2/g) |
| Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
| Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
| Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3m+n | B. | $\frac{5}{2}$m+$\frac{1}{2}$n-p | C. | $\frac{5}{2}$m+$\frac{1}{2}$n | D. | 3m+n+2p |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | 298 | 398 |
| 平衡常数K | K1 | K2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com