
【题目】乙二酸(H2C2O4)俗称草酸,为无色晶体,是二元弱酸,其电离常数Ka1=5.4×10![]() ,Ka2=5.4×10
,Ka2=5.4×10![]() 。回答下列问题:
。回答下列问题:
(1)向10 mL0.1mol·L![]() H2C2O4溶液中逐滴加入0.1mol·L
H2C2O4溶液中逐滴加入0.1mol·L![]() NaOH溶液
NaOH溶液
①当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,加入V(NaOH)___________10 mL(填“>”“=”或“<”)。
②随着苛性钠的加入,H+逐渐减少,当溶液中含碳粒子的主要存在形态为C2O42-时,溶液的酸碱性为____________(填标号)。
A.强酸性 B.弱酸性 C.中性 D.碱性
(2)某同学设计实验测定含杂质的草酸晶体(H2C2O4·2H2O)纯度(杂质不与酸性高锰酸钾反应)。实验过程如下:称取m g草酸晶体于试管中,加水完全溶解,用c mol·L![]() KMnO4标准溶液进行滴定
KMnO4标准溶液进行滴定
①通常高锰酸钾需要酸化才能进行实验,通常用_________酸化
A.硫酸 B.盐酸 C.硝酸 D.石炭酸
②则达到滴定终点时的现象是_____________________;
③该过程中发生反应的离子方程式为___________________________;
④滴定过程中消耗V mL KMnO4标准溶液,草酸晶体纯度为_________________。
(3)医学研究表明,肾结石主要是由CaC2O4 组成的,已知Ksp(CaC2O4)=2.3×10-9,若血液经血小球过滤后,形成的尿液为200 mL,其中含有Ca2+ 0.01 g。为了不形成CaC2O4 沉淀,则C2O42-的最高浓度为______ mol·L![]() 。
。
【答案】> BCD A 当最后一滴高锰酸钾溶液滴下,锥形瓶内溶液由无色变为浅紫红色,且半分钟不褪色 5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O ![]() 1.84×10-6
1.84×10-6
【解析】
(1)①根据物料守恒及Ka2=5.4×10-5,可判断c(C2O42-)>c(H2C2O4),即可判断加入NaOH的体积;
②根据Ka2即可判断HC2O4-电离程度大于水解水解,溶液显弱酸性,随加入碱的量的增大逐渐变为碱溶液;
(2)①高锰酸钾有强氧化性,通常用无还原性、产生有毒气体的硫酸酸化;
②达到滴定终点时,再滴加一滴,则高锰酸钾过量,溶液由无色变为浅紫色;
③草酸被高锰酸钾氧化生成二氧化碳,而锰变为二价锰离子;
④m(H2C2O4)=5c![]() V
V![]() 10-3
10-3![]() 90/2=0.315cV,则纯度=0.315cV/m;
90/2=0.315cV,则纯度=0.315cV/m;
(3) c(C2O42-)=Ksp(CaC2O4)/c(Ca2+);
(1)①若加入V(NaOH)=10 mL时,则溶液恰好为NaHC2O4,根据物料守恒可得:c(Na+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4),已知Ka2=5.4×10-5,则水解平衡常数Kh2=Kw/ Ka1=10-14/(5.4×10-2)<Ka2,说明HC2O4-的电离程度大于其水解程度,则c(C2O42-)>c(H2C2O4),故当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,加入的V(NaOH) >10 mL;
②已知Ka2=5.4×10-5,则水解平衡常数Kh2=Kw/ Ka2=10-14/5.4×10-2,HC2O4-电离程度大于水解,溶液显弱酸性,继续滴加NaOH溶液由酸性逐渐变为中性及碱性,答案为BCD;
(2)①高锰酸钾有强氧化性,可以氧化盐酸中的氯离子、苯酚,而硝酸能产生有毒气体,则通常用硫酸酸化;
②达到滴定终点时,再滴加一滴,则高锰酸钾过量,溶液由无色变为浅紫色,答案为:当最后一滴高锰酸钾溶液滴下,锥形瓶内溶液由无色变为浅紫红色,且半分钟不褪色;
③草酸被高锰酸钾氧化生成二氧化碳,而锰变为二价锰离子,离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
④m(H2C2O4)=5c![]() V
V![]() 10-3
10-3![]() 90/2=0.315cV,则纯度=0.315cV/m;
90/2=0.315cV,则纯度=0.315cV/m;
(3)c(Ca2+)=0.01/(40![]() 0.2)=1.25
0.2)=1.25![]() 10-3mol/L,Ksp(CaC2O4)= c(Ca2+)
10-3mol/L,Ksp(CaC2O4)= c(Ca2+)![]() c(C2O42-),c(C2O42-)=2.3×10-9/1.25
c(C2O42-),c(C2O42-)=2.3×10-9/1.25![]() 10-3=1.84×10-6mol/L;
10-3=1.84×10-6mol/L;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律151周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
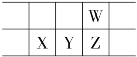
A.常温常压下,Y单质为固态
B.气态氢化物热稳定性:Z<W
C.原子半径:W<X
D.X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不能用勒夏特列原理解释的是
A. 滴有碘水的淀粉溶液中加入少量唾液,蓝色褪去
B. 对于反应2NO2![]() N2O4加压稳定后的颜色比原来颜色深
N2O4加压稳定后的颜色比原来颜色深
C. 开启可乐瓶,瓶中马上泛起大量气泡
D. 利用排液法收集氯气时常用液体为饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业排放的对苯二甲酸回收困难,经研究采用ZnO为催化剂,催化脱羧制备苯,脱羧反应机理如下。下列说法中不正确的是
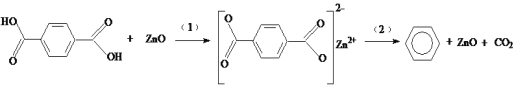
A.过程(1)中断开O—H键需要吸收能量
B.过程(2)中断开C—C键,形成C—H键
C.对苯二甲酸在脱羧反应中被还原为苯
D.ZnO能降低对苯二甲酸脱羧反应的焓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的三个不同短周期主族元素,无色气体![]() 遇空气变色,Z所在族的各元素的氢化物的水溶液均显酸性,下列说法正确的是( )
遇空气变色,Z所在族的各元素的氢化物的水溶液均显酸性,下列说法正确的是( )
A.Z单质的沸点低,故Z单质易液化
B.原子半径:![]()
C.最高价氧化物对应水化物的酸性:![]()
D.X、Y、Z与W均能形成既有极性键又有非极性键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将漫射日光照射到装有氯气和甲烷混合气体(体积比为4∶1)的装置上(如图)。现列出如下现象,其中正确的是( )
①试管内黄绿色逐渐消失 ②试管内黄绿色加深 ③无任何现象 ④试管内液面上升 ⑤试管内壁上有油状物生成
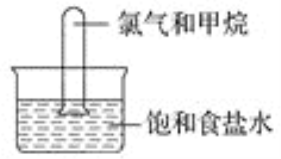
A. ① B. ①④和⑤
C. ①和⑤ D. ②和⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是一种重要的有机化工原料,其结构简式为![]() ,它一般不可能具有的性质是( )
,它一般不可能具有的性质是( )
A.难溶于水,易溶于有机溶剂,在空气中燃烧产生黑烟
B.分子中的所有原子一定在同一平面内
C.它能使溴的四氯化碳溶液褪色,也能使酸性高锰酸钾溶液褪色
D.能发生加成反应,在一定条件下最多可与四倍物质的量的氢气加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加工含硫原油时,需除去其中含硫物质。
(1)铁离子浓度是原油加工中防腐监测的重要指标。测定铁离子浓度前,需去除原油加工产生的酸性废水中的硫化氢及其盐。实验室模拟过程如下。
Ⅰ.将250mL酸性废水置于反应瓶中,加入少量浓盐酸,调节pH小于5。
Ⅱ.在吸收瓶中加入饱和氢氧化钠溶液。
Ⅲ.打开脱气—吸收装置,通入氮气,调节气流速度,使气体依次经过反应瓶和吸收瓶。当吹出气体中H2S体积分数达到标准,即可停止吹气。
已知:含硫微粒的物质的量分数(δ)随pH变化情况如下图所示。

①步骤Ⅰ中加入浓盐酸调节pH<5的原因是_______________________。
②步骤Ⅱ中,当测得吸收液的pH为 ______时,需要更换NaOH溶液。
③利用邻菲罗啉分光光度法可测定样品中的含铁量。测定前需用盐酸羟基胺(NH2OH·HCl)将Fe3+还原为Fe2+。将下述离子方程式补充完整:_______Fe3++______NH2OH·HCl=____Fe2++N2↑+________+_________+__________Cl-
(2)原油中的硫化氢还可采用电化学法处理,并制取氢气,其原理如下图所示。
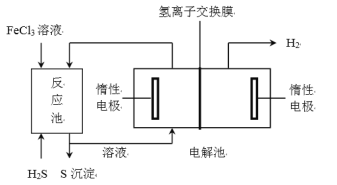
①写出反应池内发生反应的离子方程式_____________________________________。
②电解池中,阳极的电极反应为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是
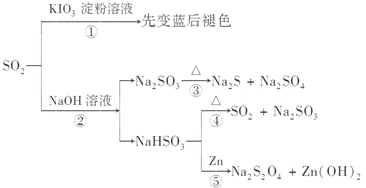
A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性
B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2
C.反应③④⑤均属于氧化还原反应
D.工业上可利用反应②和反应④回收SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com