
【题目】CO和CO2是碳的两种氧化物,请计算:
(1)在标准状况下,5.6LCO的物质的量是__________,质量是__________。
(2)11gCO2在标准状况下的体积是__________。
(3)相同物质的量的CO和CO2所含氧原子个数之比为__________。
【答案】0.25mol 7g 5.6L 1:2
【解析】
(1)根据n=![]() 计算气体的物质的量,结合m=nM计算气体的质量;
计算气体的物质的量,结合m=nM计算气体的质量;
(2)先根据m=nM计算气体的物质的量,然后根据n=![]() 计算气体的物质的量;
计算气体的物质的量;
(3)根据n=![]() 及物质分子中含有的氧原子个数计算。
及物质分子中含有的氧原子个数计算。
(1)在标准状况下,5.6LCO的物质的量n(CO)=5.6L÷22.4L/mol=0.25mol,其质量m(CO)=n·M=0.25mol×28g/mol=7g;
(2)11gCO2气体的物质的量n(CO2)=11g÷44g/mol=0.25mol,该气体在标准状况下的体积V(CO2)=0.25mol×22.4L/mol=5.6L;
(3)由n=![]() 可知:气体的物质的量的比等于气体分子数的比。由于CO、CO2分子中分别含有1个、2个O原子,所以相同物质的量的CO和CO2所含氧原子个数之比为1:2。
可知:气体的物质的量的比等于气体分子数的比。由于CO、CO2分子中分别含有1个、2个O原子,所以相同物质的量的CO和CO2所含氧原子个数之比为1:2。


科目:高中化学 来源: 题型:
【题目】右图是373K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是 ( )

A. 该反应的热化学方程式为:N2+3H2![]() 2NH3 △H=-92kJ·mol-1
2NH3 △H=-92kJ·mol-1
B. 加入催化剂,该化学反应的反应热不变
C. a曲线是加入催化剂时的能量变化曲线
D. 在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为Q1kJ,则Q1=92
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
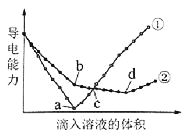
下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置及药品能实现相应实验目的的是

A. 甲用于制取NaHCO3晶体 B. 乙用于分离I2和NH4Cl
C. 丙用于证明非金属性强弱:Cl>C>Si D. 丁用于测定某稀醋酸的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧锂离子电池正极材料的主要成分为碳棒和![]() ,另含少量
,另含少量![]() 、
、![]() 杂质。某厂按如图流程对废旧锂离子电池的正极进行回收再生。回答有关问题:
杂质。某厂按如图流程对废旧锂离子电池的正极进行回收再生。回答有关问题:
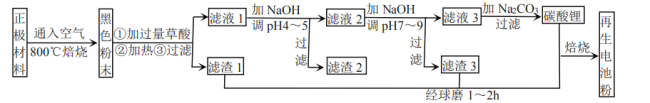
已知:①草酸电离常数:![]() ,
,![]() ;草酸的酸式盐以及草酸锂均可溶。
;草酸的酸式盐以及草酸锂均可溶。
②常温时,有关物质Ksp如下表(单位略):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)通入空气,800℃焙烧目的是___________________________。
(2)已知![]() 中
中![]() 、
、![]() 、
、![]() 化合价相同,则它们的化合价为_________。
化合价相同,则它们的化合价为_________。
(3)加入草酸加热时,![]() 、
、![]() 、
、![]() 元素部分转化为
元素部分转化为![]() 、
、![]() 、
、![]() 沉淀,而另一部分以草酸的酸式盐形式进入溶液。写出
沉淀,而另一部分以草酸的酸式盐形式进入溶液。写出![]() 与草酸反应生成
与草酸反应生成![]() 沉淀的化学方程式_________。
沉淀的化学方程式_________。
(4)焙烧后黑色粉的平均粒度(颗粒直径表示)与![]() 的浸出率关系如图所示,原因是___________。
的浸出率关系如图所示,原因是___________。

(5)滤液1加![]() 调pH为4~5目的是_____________________。
调pH为4~5目的是_____________________。
(6)滤液2调![]() 时,溶液中
时,溶液中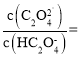 ___________。
___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.8g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.
B.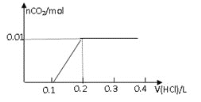
C.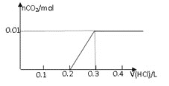
D.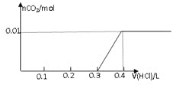
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸奥司他韦是临床常用的抗病毒药物,常用于甲型和乙型流感治疗。其中间体结构简式如图所示,关于该有机物下列说法错误的是( )
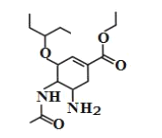
A.分子式为![]()
B.该有机物既能与酸反应又能与碱反应
C.该有机物分子中含有3个手性碳原子
D.1mol 该有机物最多能与3mol![]() 发生加成反应
发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化反应与还原反应在同一元素间进行的是
A.Cl2 + 2NaOH = NaCl + NaClO + H2O
B.Fe + CuSO4 = FeSO4 + Cu
C.2KClO3 ![]() 2KCl + 3O2↑
2KCl + 3O2↑
D.2H2O ![]() 2H2↑+ O2↑
2H2↑+ O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制0.50 mol·L-1 NaCl溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、________、________以及等质量的几片滤纸。
(2)计算。配制该溶液需称取NaCl晶体的质量为________g。
(3)称量。
①称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。
②称量完毕,将药品倒入烧杯中。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是________________________。
(5)转移、洗涤。在转移时应使用____________________引流,洗涤烧杯2~3次是为了________________________________。
(6)定容,摇匀。
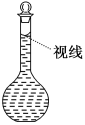
(7)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com