
| ①H2SO4溶液中的HSO4- | ②NaHSO4溶液中的HSO4- | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
| (cα)2 |
| c(1-α) |
| c(CH3COO-)×c(H+) |
| CH3COOH |
| (cα)2 |
| c(1-α) |
| c×α2 |
| 1-α |
| 0.1×0.01332 |
| 1-0.0133 |
| b |
| 2 |
| c(CH3COO-)×c(H+) |
| CH3COOH |
| 0.005×10-7 | ||
|
| 10-9 |
| b |
| 10-9 |
| b |


科目:高中化学 来源: 题型:
| A、向燃着的酒精灯里添加酒精 |
| B、碱溶液沾到皮肤上,用较多的水冲洗,再涂上硼酸溶液 |
| C、将反应后的酸性溶液直接倒入下水道中 |
| D、金属钠着火时,立即用大量水扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、在酸性溶液中:Na+、K+、NO
| ||||
B、在中性溶液中:Al3+、K+、SO
| ||||
C、25℃时pH=0的溶液中:Al3+、NH
| ||||
D、c(H+)<c (OH-)的溶液中:Na+、K+、SO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F六种元素的原子序数依次增大.A的最高正价和最低负价的绝对值相等.B的基态原子有3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题:
A、B、C、D、E、F六种元素的原子序数依次增大.A的最高正价和最低负价的绝对值相等.B的基态原子有3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
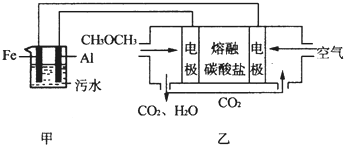
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、NaHCO3溶液加水稀释,
| ||||
| B、浓度均为0.1 mol?L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)] | ||||
| C、在高锰酸钾溶液中,H+、K+、SO42-、葡萄糖分子可以大量共存 | ||||
| D、已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=1.9×10-12,则Ag2CrO4的溶解度小于AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B的转化率降低 |
| B、平衡向正反应方向移动 |
| C、x+y<z |
| D、C的体积分数下降 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com