
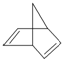
 ,其分子式为C7H8.
,其分子式为C7H8. .
. 分析 (1)该分子中含有7个C原子、8个H原子,据此判断化学式;
(2)该分子中含有碳碳双键且不含苯环,该物质中只含C、H元素;
(3)该物质中含有碳碳双键,具有烯烃性质;
(4)在一定条件下,该物质中碳碳双键和氢气发生加成反应生成碳碳单键.
解答 解:(1)该分子中含有7个C原子、8个H原子,据此判断化学式为C7H8,故答案为:C7H8;
(2)该分子中含有碳碳双键且不含苯环,且该物质中只含C、H元素,所以该物质属于环烃和不饱和烃,故选AB;
(3)该物质中含有碳碳双键,具有烯烃性质,不能溶于水,能发生氧化反应和加成反应,但其碳原子个数大于4,为液体,故选AD;
(4)在一定条件下,该物质中碳碳双键和氢气发生加成反应生成碳碳单键,反应方程式为 ,
,
故答案为: .
.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查烯烃性质,题目难度不大.


科目:高中化学 来源: 题型:解答题
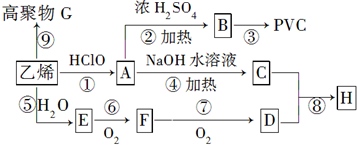
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
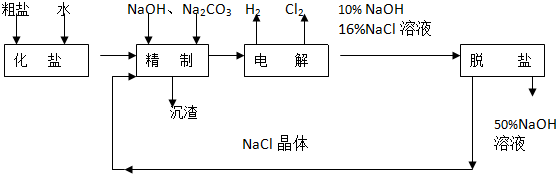
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应中KMnO4被氧化 | |
| B. | HCl发生还原反应 | |
| C. | 每消耗2mol HCl时,反应中转移的电子为2 mol | |
| D. | 氧化剂与还原剂的物质的量之比为1﹕5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯 | B. | CH3CHO | C. | CH3COOH | D. | CH2=CH-COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-+H2O HCO3-+OH-; 用热的纯碱溶液清洗油污 | |
| B. | SnCl2+H2OSn( OH)Cl+HCl;配制氯化亚锡溶液时加入氢氧化钠溶液 | |
| C. | A13++3HCO3-=Al (OH)3↓+3CO2↑;泡沫灭火器灭火 | |
| D. | A13++3H2OAl (OH)3(胶体)+3H+;明矾净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠和水反应:2Na2O2+2 H2O=4Na++4OH-+O2↑ | |
| B. | 氧化铝溶于氢氧化钠溶液:Al2O3+2 OH-=2AlO2-+H2↑ | |
| C. | 氢氧化钡溶液滴入稀硫酸中:Ba2++OH一+H++SO42-=BaSO4↓+H2O | |
| D. | 二氧化碳通入足量氢氧化钠溶液:CO2+OH-=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com