
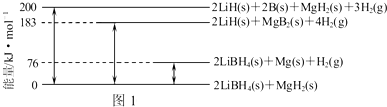
分析 (1)B是原子序数是5,所以在元素周期表中的位置为第二周期,第ⅢA族;
(2)反应2LiBH4═2LiH+2B+3H2↑,可知生成3mol的氢气转移6mol的电子,则生成22.4L H2(标准状况)时,也就是产生1mol的氢气,转移电子的物质的量为2mol;
(3)应用盖斯定律,来解答;
(4)依据题意,反应物为Co2+与肼(N2H4)、碱性条件下存在OH-,生成物为:钴单质,据此得出Co的化合价降低,故N的化合价升高,只能为0价,即氮气,依据氧化还原反应得失电子守恒回答即可.
解答 解:(1)B是原子序数是5,所以在元素周期表中的位置为第二周期,第ⅢA族,故答案为:第二周期,第ⅢA族;
(2)反应2LiBH4═2LiH+2B+3H2↑,可知生成3mol的氢气转移6mol的电子,则生成22.4L H2(标准状况)时,也就是产生1mol的氢气,转移电子的物质的量为2mol,故答案为:2;
(3)由图可知:2LiBH4(s)+MgH2(s)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+200 kJ•mol-1①
2LiBH4(s)+MgH2(s)=2LiBH4(s)+Mg(s))+H2(g)△H=+76 kJ•mol-1②
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+183 kJ•mol-1③
2LiH(s)+MgB2(s)+4H2(g)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+(200-183)kJ•mol-1④
即:MgB2(s)+H2(g)=2B(s)+MgH2(s)△H=+17 kJ•mol-1④
所以-④-②得:Mg(s)+2B(s)═MgB2(s)△H=-(17+76)kJ•mol-1
故答案为:-93 kJ•mol-1;
(4)依据题意,反应物为Co2+与肼(N2H4)、碱性条件下存在OH-,生成物为:钴单质,据此得出Co的化合价降低,故N的化合价升高,只能为0价,即氮气,据此得出还有水生成,氧化还原反应中存在得失电子守恒以及元素守恒,故此反应的离子反应方程式为:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O,
故答案为:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O.
点评 本题考查元素化合物知识,涉及热化学方程式的书写,盖斯定律的应用,离子方程式的书写,综合性非常强,难度大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知常温下0.1 mol.L -1NaCN溶液的pH=12,则已水解的CN -约占总数的10% | |
| B. | 已知25℃时NH4CN溶液显碱性,则25℃时的电离常数K(NH 3.H 2O)>K(HCN) | |
| C. | NH4ClO4溶液中,c(ClO4-)>c (NH4+)>c(OH -)>?c(H +)? | |
| D. | 欲使0.1 mol•L-1Na2S溶液中$\frac{c(Na)^{+}}{c({S}^{2-})}$更接近2,可加入适量KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将两种溶液都稀释100倍,醋酸的pH大于盐酸 | |
| B. | 用相同浓度的氢氧化钠溶液中和,消耗氢氧化钠的体积相等 | |
| C. | 分别加入质量相同的足量锌粉,开始时盐酸反应速率快 | |
| D. | 盐酸的浓度为0.01mol•L-1,醋酸浓度大于0.01mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | Na2CO3溶液中:2c(Na+)=c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(H2CO3) | |
| C. | NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO${\;}_{3}^{2-}$) | |
| D. | 常温下,pH=4.75、浓度均为0.1mol•L-1的CH3COOH和CH3OONa混合液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
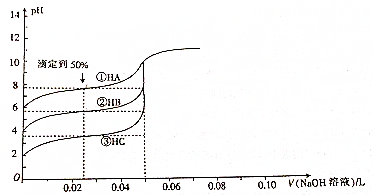
| A. | Ka(HA)>Ka(HB)>Ka(HC) | |
| B. | 滴定到50%时,溶液中:c(A-)>(B-)>(C-) | |
| C. | V(NaOH)溶液=50mL时,溶液中水的电离程度:①>②>③ | |
| D. | V(NaOH)溶液=50mL时,溶液pH的大小关系:pH(A)<pH(B)<pH(C) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com