
| A. | H3的摩尔质量是3g | |
| B. | H3是氢元素的一种新的同位素 | |
| C. | H3分子中含有3个中子 | |
| D. | H2和H3是氢元素形成的两种不同单质 |
科目:高中化学 来源: 题型:解答题
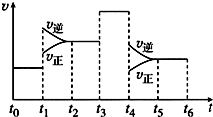 300℃下,将2mol SO21mol O2混合于2L的恒容密闭容器中,发生反应:2SO2(g)+O2(g)?2SO3(g)△H,2分钟末达到平衡,测得SO2的转化率为60%,请根据化学反应的有关原理回答下列问题:
300℃下,将2mol SO21mol O2混合于2L的恒容密闭容器中,发生反应:2SO2(g)+O2(g)?2SO3(g)△H,2分钟末达到平衡,测得SO2的转化率为60%,请根据化学反应的有关原理回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,溶液中c(OH-) 增大 | |
| B. | 加入少量NH4Cl固体,平衡向逆方向移动,电离平衡常数减小 | |
| C. | 通入少量HCl气体,溶液中c(NH4+)增大 | |
| D. | 降低温度,促进NH3•H2O电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
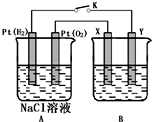 某化学兴趣小组用下图所示装置进行电化学原理的实验探究,回答下列问题:
某化学兴趣小组用下图所示装置进行电化学原理的实验探究,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①③②④ | C. | ②①④③ | D. | ①④②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度的下列溶液:①H2CO3 ②Na2CO3 ③NaHCO3 ④(NH4)2CO3其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c( HC2O4-)+c( C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com