
A. FeO B. Fe3O4 C. Fe4O5 D.Fe5O7
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:

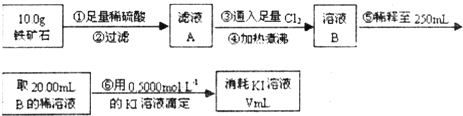
查看答案和解析>>
科目:高中化学 来源: 题型:013
某铁的氧化物,用7 mol•L-1的盐酸100 mL在一定条件下恰好完全溶解,所得溶液再通入0.56 L(标准状况下)的氯气时,刚好使溶液中Fe2+完全转化为Fe3+。则该氧化物的化学式可表示为( )
A. FeO B. Fe3O4 C. Fe4O5 D.Fe5O7
查看答案和解析>>
科目:高中化学 来源:江西省安福中学2011届高三上学期第一次月考化学试题 题型:013
|
某铁的氧化物,用7 mol·L-l的盐酸100 mL在一定条件下恰好完全溶解,所得溶液再通入0.56 L标准状况下的氯气时,刚好使溶液中Fe2+完全转化为Fe3+.则该氧化物的化学式可表示为 | |
| [ ] | |
A. |
FeO |
B. |
Fe3O4 |
C. |
Fe4O5 |
D. |
Fe5O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.FeO B.Fe3O4 C.Fe4O5 D.Fe5O7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com