
|
盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同.已知:H2O(g)=H2O(l)△H1=—Q1kJ/mol C2H5OH(g)=C2H5OH(l)△H2=—Q2kJ/mol C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H3=—Q3kJ/mol 若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为(单位均为kJ) | |
| [ ] | |
A. |
Q1+Q2+Q3 |
B. |
0.5(Q1+Q2+Q3) |
C. |
1.5Q1-1.5Q2+0.5Q3 |
D. |
1.5Q1-0.5Q2+0.5Q3 |
科目:高中化学 来源: 题型:阅读理解
 (1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总
(1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Q1+Q2+Q3 | B、0.5(Q1+Q2+Q3) | C、0.5 Q1-1.5 Q2+0.5Q3 | D、1.5 Q1-0.5 Q2+0.5Q3 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西省南昌二中高二上学期期末考试化学试卷 题型:填空题
(12分)(1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知: C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);ΔH1=-Q1 kJ/mol,C2H5OH(g)=C2H5OH
(l);ΔH2=-Q2 kJ/mol,H2O(g)=H2O(l);ΔH3=-Q3 kJ/mol。若使23g液态无水酒精完全
燃烧,并恢复到室温,则整个过程中放出的热量为 ________________ kJ。
(2)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体。火炬内
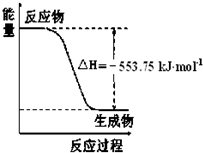
熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题: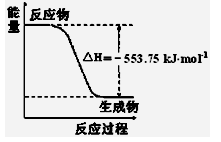
①右图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,请写出表示丙烷燃烧热的热化学方程式 。
②近年来已经研制出丙烷燃料电池,该电池的电解质溶液为KOH溶液,写出该电池负极的电极反应式:__________________________________________。
③某金属的相对原子质量为52.00,用上述电池电解该金属的一种含氧酸盐的酸性水溶液时,阳极每放出 3360ml(标准状况)氧气体,阴极析出金属 10.4 g,在该含氧酸盐中金属的化合价为 ____ ,在该实验中,若不考虑能量的损失,电池中消耗丙烷的质量最少是 __ g(结果精确至0.01 g)。?
④二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为 ____ 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第5讲 化学反应与能量练习卷(解析版) 题型:填空题
(1)2012年伦敦奥运会火炬采用丙烷为燃料。丙烷热值较高,污染较小,是一种优良的燃料。试回答下列问题:

①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“-”。
②写出表示丙烷燃烧热的热化学方程式:___________________________________。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为________。
(2)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知:H2O(g)=H2O(l) ΔH1=-Q1 kJ/mol C2H5OH(g)=C2H5OH(l) ΔH=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-Q3 kJ/mol
若使46 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为________kJ。
②碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应: C(s)+ O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
查看答案和解析>>
科目:高中化学 来源:2015届山东省临沂市高二上学期期中考试化学试卷(解析版) 题型:选择题
盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)=H2O(l)ΔH1 =-Q1kJ/mol
C2H5OH(g)=C2H5OH(l) ΔH2 =-Q2kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3 =-Q3kJ/mol
若使0.5mol乙醇液体完全燃烧,最后恢复到室温,则放出的热量为(kJ)
A.Q1+Q2+Q3
B.0.5(Q1+Q2+Q3)
C.0.5 Q2-1.5 Q1-0.5Q3
D.1.5 Q1-0.5 Q2+0.5Q3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com